УДК 597.851(576.354.4)
Сравнение устойчивости сперматогенеза у гемиклонального межвидового гибрида Pelophylax esculentus и родительского вида Pelophylax ridibundus (Amphibia, Anura)
А.О. Вегерина, О.В. Бирюк, Д.А. Шабанов
Харьковский национальный университет им. В.Н. Каразина, пл. Свободы, 4, Харьков, 61077 Украина
E-mail: anastasia.vegerina@gmail.com; mykhailova.o.v@gmail.com; d.a.shabanov@gmail.com
Сравнение устойчивости сперматогенеза у гемиклонального межвидового гибрида Pelophylax esculentus и родительского вида Pelophylax ridibundus (Amphibia, Anura). Вегерина А.О., Бирюк О.В., Шабанов Д.А. — Представлены результаты кариологического изучения клеток зародышевой линии самцов межвидовых гибридов Pelophylax esculentus и одного из его родительских видов, P. ridibundus. Анеуплоидные клетки были зарегистрированы как у гибридов, так и у особей родительского вида, однако средняя встречаемость сперматоцитов I с неправильным количеством бивалентов существенно выше у P. esculentus. Диапазон изменений доли нормальных клеток у особей в пределах выборки гибридов варьирует значительно шире, чем у P. ridibundus. Мы сделали вывод об относительной неустойчивости механизма гемиклонального наследования, которая приводит к затруднениям сперматогенеза и снижению эффективности воспроизводства межвидовых гибридов.
Ключевые слова: Pelophylax esculentus, сперматогенез, нарушения, анеуплоидия, гемиклональность.
Comparison of spermatogenesis stability in hemiclonal interspecific hybrid Pelophylax esculentus and parental species Pelophylax ridibundus (Amphibia, Anura). Vegerina A.O., Biriuk O.V., Shabanov D.A. — The article presents the results of karyological study of male germline cells of interspecific hybrid Pelophylax esculentus and one of its parental species P. ridibundus. Aneuploid cells were detected in both, hybrids and parental species individuals, but the average frequency of spermatocytes I with the wrong number of bivalents is significantly higher in P. esculentus. The range of changes in the normal cells proportion among the individualsin the sample of hybrids varies significantly wider than among P. ridibundus. We have concluded that the comparative instability of hemiсlonal inheritance mechanism leads to difficulties in spermatogenesis and reduction of the interspecific hybrids reproductive efficiency.
Key words. Pelophylax esculentus, spermatogenesis, abnormalities, aneuploidy, hemiclonality.
Введение
В гибридогенный комплекс зеленых лягушек (Pelophylax esculentus complex) входят два родительских вида: прудовая лягушка, Pelophylax lessonae (Camerano,1882) и озерная лягушка, Pelophylax ridibundus (Pallas, 1771), а также их гибриды (Berger, 1964). Для обозначения межвидовых гибридов по ряду причин используется название, аналогичное видовому — съедобная лягушка, Pelophylax esculentus (Linnaeus, 1758). Как правило, у P. esculentus в гаметы переходит только один родительский геном, который без рекомбинации (клонально) наследуется в ряду поколений (Tunner, 1974). Такое воспроизводство называется гемиклональным (Plötner, 2005). В типичном случае P. esculentus обитают и воспроизводятся совместно с представителями одного или обоих родительских видов, образуя гемиклональные популяционные системы, ГПС (Шабанов, Литвинчук, 2010). Для региона, названного Северско-Донецким центром разнообразия зеленых лягушек, характерны ГПС, состоящие из диплоидных и триплоидных P. esculentus, а также P. ridibundus (Шабанов, Литвинчук, 2010). P. lessonae в этом регионе отсутствует, и все ее геномы передаются через межвидовых гибридов, P. esculentus.
Гемиклональное воспроизводство гибридов обеспечивается специфическим характером гаметогенеза, который, по сути, является аномальным (при сравнении с типичным, характерным для представителей родительских видов). Геномы родительских видов P. esculentus complex отличаются настолько, что типичный мейоз у гибрида оказывается невозможным. Адаптация, позволяющая обойти это затруднение, заключается в том, что из клеток зародышевой линии ещё до начала мейоза удаляется один из родительских геномов. В серии цитогенетических исследований с применением флуоресцентной микроскопии австрийские авторы Х. Туннер и С. Хеппих-Туннер показали, что удаление неклонального генома происходит во время митотических делений клеток зародышевой линии. После этого клональный геном удваивается (дуплицируется), причем этот процесс протекает до вступления клеток в мейоз или же у самок может происходить уже в ходе мейоза (Tunner, Heppich-Tunner, 1991). У триплоидных особей гаметогенез протекает аналогично, за исключением стадии удвоения (Vinogradov et al., 1991; Plötner, 2005). Вследствие таких аномальных процессов у гибридных лягушек, по сравнению с представителями родительских видов, воспроизводство сталкивается с рядом трудностей, к числу которых относятся нарушения развития гонад, аномалии личиночного развития, появление мозаичных особей, уменьшение жизнеспособности и продолжительности жизни (Berger, 2008; Михайлова и др., 2011).
Особенности гаметогенеза представителей Северско-Донецкого центра разнообразия зеленых лягушек изучались с применением различных методик, в том числе при помощи проточной ДНК-цитометрии суспензии сперматозоидов (Боркин и др., 2005); получения метафазных пластинок из разрушенных клеток (Сурядная, 2003; Манило и др., 2007); при помощи электорофоретического анализа суспензии половых клеток (Межжерин и др., 2007; Морозов-Леонов и др., 2009). Работы по изучению овогенеза P. esculentus проводили также при помощи маркеров хромосом типа ламповых щеток и методики FISH (Dedukh et al., 2015).
Кроме прочего, для изучения сперматогенеза применяли кариоанализ в давленых препаратах (Михайлова и др., 2011). На основании результатов перечисленных работ можно утверждать, что во многих клеточных линиях гибридов гаметогенез, который можно считать для них нормальным (с учетом его аномальности по сравнению с типичным случаем рекомбинантного наследования), нарушается. Следствием таких нарушений является появление значительного количества анеуплоидных и полиплоидных клеток зародышевой линии (вероятнее всего, в подавляющем большинстве не доходящих до стадии зрелых гамет). Это означает, что у P. esculentus в связи с гемиклональным наследованием процесс образования гамет протекает неустойчиво. Однако полученные результаты носят описательный характер, количественный учет нарушений в ходе гаметогенеза, который позволил бы оценить груз гемиклональности, до настоящего момента не производился.
На основании вышесказанного можно утверждать, что сравнение устойчивости сперматогенеза у диплоидных межвидовых гибридов зеленых лягушек (P. esculentus) и родительских видов гибридогенного комплекса представляет значительный интерес. В связи с этим, задачей данной работы стало описание и подсчет аномальных митотических и мейотических пластинок в семенниках гибридов P. esculentus и одного из родительских видов P. ridibundus. Для этого мы применяли метод кариоанализа по препаратам раскапанных клеток.
Материал и методы
Мы исследовали выборку из 23 особей зеленых лягушек, в которую входили 10 диплоидных самцов P. esculentus и 13 самцов P. ridibundus из Северско-Донецкого центра разнообразия P. esculentus complex. Лягушек отловили с июня по октябрь 2013 г. в окрестностях с. Гайдары, с. Гениевка и с. Сухая Гомольша Змиевского района Харьковской области, а также в черте города Харькова (улица Тимуровцев). Видовую принадлежность лягушек определяли по комплексу внешних признаков (Шабанов и др., 2006). Для особей, собранных в черте города, состав генома был определен с помощью проточной ДНК-цитометрии, которая выполнялась Ю.М. Розановым и С.Н. Литвинчуком в ЦИН РАН (г. Санкт-Петербург). Для проведения кариологического анализа у животных были взяты фрагменты кишечника и семенники. Для косвенного определения плоидности у зеленых лягушек получали и исследовали мазки крови согласно опубликованной методике (Бондарева и др., 2012).
Каждая исследуемая особь за сутки до забоя получала внутрибрюшинную инъекцию 0,04% водного раствора колхицина по 0,1–0,3 мл (в зависимости от массы). Полученные в ходе вскрытия материалы промывали, разрезали на фрагменты и помещали в гипотонический раствор (0,07М КCl), на 20 мин. Затем раствор заменяли фиксатором Карнуа (3 части метанола и одна часть ледяной уксусной кислоты), при этом смену фиксатора производили трижды через каждые 30 мин. Из фиксированных материалов приготавливали кариологические препараты методом раскапывания. Для этого фрагмент ткани переносили в 70% раствор уксусной кислоты, где он мацерировался до образования суспензии клеток. Полученную суспензию наносили на нагретые до 60°C на нагревательном столике предметные стекла при помощи пастеровской пипетки в виде капель диаметром 1 см. Нанесенные капли немедленно забирали пипеткой, в результате чего на стеклах оставалось небольшое количество отдельно лежащих клеток. Препараты высушивали и помещали в термостат при температуре 37°C на 3 недели.
Окончательное определение плоидности проводили с помощью подсчета хромосом (26 для диплоидов или 39 для триплоидов) в не менее чем семи метафазных пластинках из соматической ткани каждой особи. В случае, когда метафазных пластинок, пригодных для подсчета в них хромосом, было недостаточно, плоидность определяли на основании числа ядрышек в ядрах не менее, чем 20 клеток. Для этого нами было использовано окрашивание нитратом серебра (серебрение) — метод, применяемый для обнаружения района ядрышкового организатора (РЯО, сайты 18S + 28S рДНК) в метафазных хромосомах, а также ядрышек в интерфазных ядрах соматических клеток (Birshtein, 1984; Schmid, 1982). В результате серебрения ядрышки становятся отчетливо видны как темные участки: два в ядрах диплоидных особей, и, соответственно, три — в ядрах триплоидных (Вегерина и др., 2013). Окрашенные нитратом серебра препараты помещали в 2% раствор красителя Гимзы, а затем промывали в дистиллированной воде и высушивали. Все изученные нами особи оказались диплоидными.
На полученных препаратах семенников выбирали клетки, находящиеся на разных стадиях митотического или мейотического деления. Пригодные для анализа пластинки микроскопировали с увеличением в 160, 640 и 1600 раз с масляной иммерсией и фотографировали при помощи цифровой USB-камеры для микроскопа (ScienceLab View.7). На полученных фотографиях производили подсчет структур в пластинках на стадиях метафазы митоза, а также стадии диакинеза и метафазы I мейоза, в которых количество и структура хромосом или бивалентов видны наиболее отчетливо.
Статистическую обработку полученных данных производили с помощью программы Statistica.
Результаты и обсуждение
В семенниках зеленых лягушек нами было зарегистрировано значительное количество анеуплоидных клеток, то есть клеток, имеющих количество хромосом, некратное гаплоидному набору. Анеуплоидные клетки мы наблюдали на разных стадиях гаметогенеза, причем как у гибридных особей, так и у особей родительских видов. Число хромосом в таких клетках колебалось в очень широких пределах. В то время как диплоидный набор у зеленых лягушек составляет 26 хромосом (рис. 1), мы регистрировали гипогаплоидные (меньше 13), гипергаплоидные (больше 13), гиподиплоидные (меньше 26) и гипердиплоидные (больше 26) пластинки (рис. 2). Наличие гипогаплоидных, гипергаплоидных и гиподиплоидных пластинок частично можно было бы объяснить потерями при изготовлении кариологических препаратов методом раскапывания или, иначе говоря, списать на ошибку метода. Впрочем, следует учесть, что в использованном нами варианте кариоанализа проходило раскапывание не свободно взвешенных метафазных пластинок (что повышает вероятность потери части хромосом или наложения пластинок), а целых клеток, что резко уменьшает вероятность ошибок. Еще сложнее было бы объяснить ошибкой метода появление гипердиплоидных пластинок. Их наличие прямо указывает на нарушения в характерном для P. esculentus механизме гаметогенеза. Наконец, следует указать, что характер пространственного распределения хромосом указывает на то, что увеличение плоидности происходило в результате нарушений расхождения, а не наложения разных пластинок.
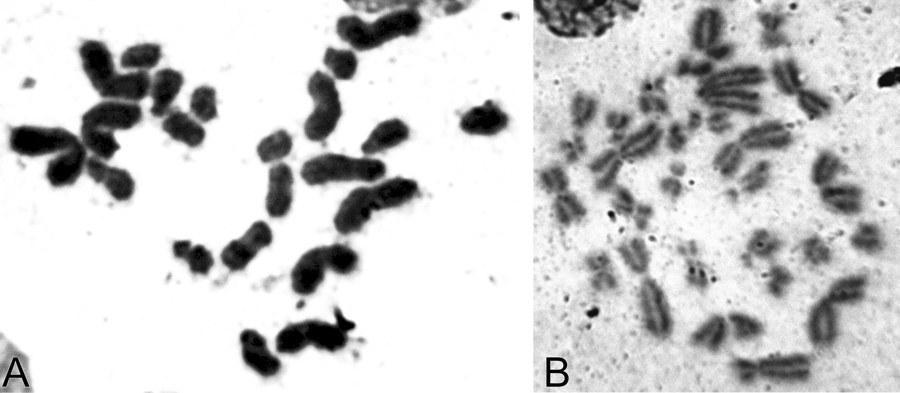
Рис. 1. Сперматогоний диплоидного самца P. esculentus. 2n метафаза митоза, 26 хромосом: А — метафазная пластинка; В — кариограмма.
Fig. 1. P. esculentus diploid male’s spermatogonia. 2n metaphase of mitosis, 26 chromosomes: A — metaphase plate; B — karyogram.
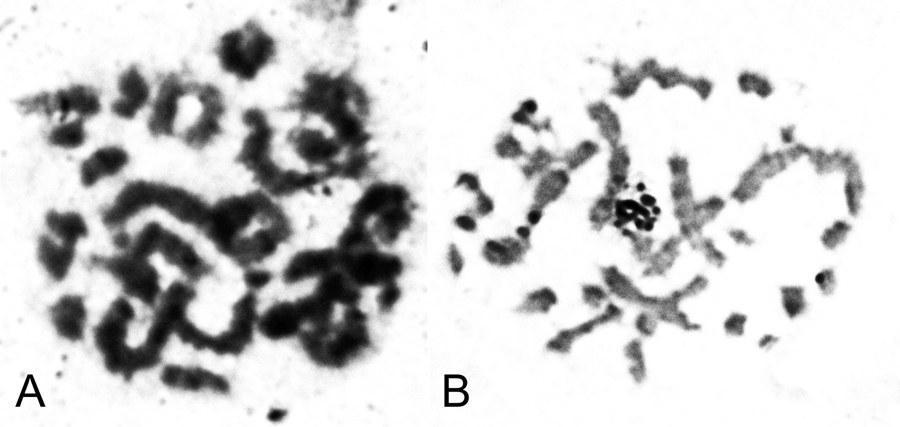
Рис. 2. Анеуплоидные сперматогонии диплоидных самцов P. esculentus. Гиподиплоидный набор хромосом на стадии метафазы митоза, 22 хромосомы: А — метафазная пластинка; В — кариограмма. Гипердиплоидный набор хромосом на стадии метафазы митоза: C — метафазная пластинка; D — кариограмма.
Fig. 2. Aneuploid spermatogonia of P. esculentus diploid males. Hyperdiploid chromosome set in metaphase of mitosis, 22 chromosomes: A — metaphase plate, B — karyogram. Hypodiploid chromosome set in metaphase of mitosis, 28 chromosomes: C — metaphase plate; D — karyogram.
В мейозе мы также наблюдали анеуплоидные и удвоенные наборы бивалентов и, кроме того, нарушения в образовании самих бивалентов — униваленты, количество которых, в свою очередь, также могло быть некратным гаплоидному набору (рис. 3). Следует отметить, что другими авторами, изучавшими самок P. esculentus, также были отмечены как анеуплоидные клетки среди оогониев (Tunner, Heppich-Tunner, 1991), так и ооциты, содержащие униваленты, удвоенное число бивалентов и даже биваленты и униваленты одновременно (Dedukh et al., 2015). В семенниках трех диплоидных самцов P. esculentus помимо анеуплоидных пластинок были найдены полиплоидные — 3n и 4n пластинки (рис. 4). Следует подчеркнуть, что у этих особей в соматических тканях наблюдали только диплоидные наборы хромосом и размер эритроцитов также колебался в пределах, соответствующих размерам диплоидных клеток (Бондарева и др., 2012).
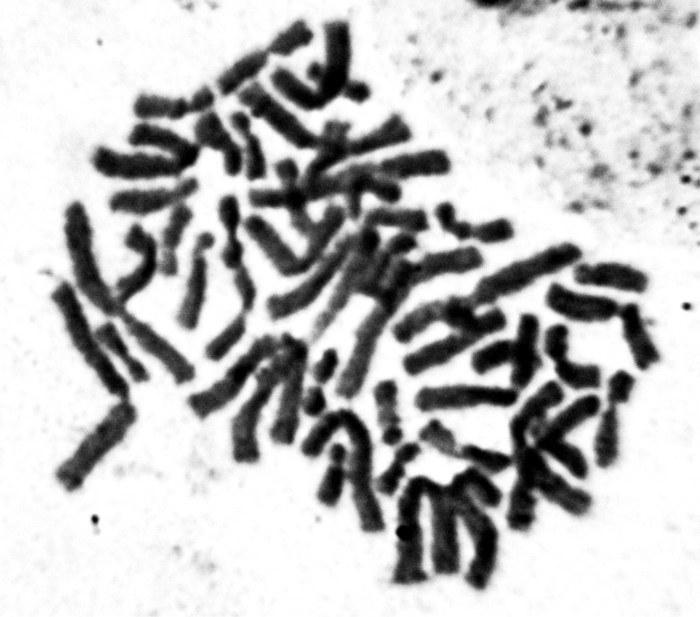
Рис. 3. Сперматоциты I диплоидных самцов P. esculentus: А — профаза I мейоза, 13 бивалентов (норма); В — профаза I мейоза, 26 бивалентов; С — 13 унивалентов.
Fig. 3. P. esculentus diploid male’s spermatocytes I: A — prophase I of meiosis; 13 bivalents (normal); B — prophase I of meiosis, 26 bivalents; C — 13 univalents.
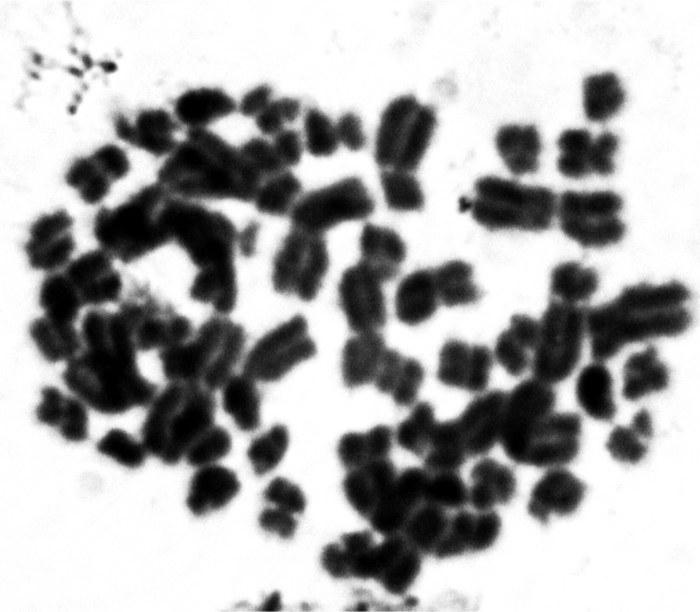
Рис. 4. Cперматогония диплоидного самца P. esculentus. Метафаза митоза, 51 хромосома (норма — 4n = 52), одна хромосома из 5-й пары отсутствует: А — метафазная пластинка; В — кариограмма.
Fig. 4. P. esculentus diploid male’s spermatogonia. Metaphase of mitosis, 51 chromosomes (normal — 4n = 52), one chromosome in 5-st pair have been lost: A — metaphase plate; B — karyogram.
В целом зарегистрированная для P. esculentus картина аномалий соответствовала результатам предыдущих исследований, проведенных нами с использованием иного метода (Михайлова и др., 2011). Кроме того, эти результаты совпадают с данными других авторов по лягушкам из Харьковской области (Сурядна, 2005; Манило и др., 2007, Dedukh et al., 2015), а также перекликаются с данными, полученными при изучении популяций зеленых лягушек из западной Европы (Günther, 1975; Tunner, Heppich-Tunner, 1991).
В семенниках P. ridibundus аномальные клетки с неправильным количеством структур встречались реже, чем у гибридных особей. Все зарегистрированные нарушения P. ridibundus были аналогичны описанным выше для P. esculentus. У одного из самцов озерной лягушки нами была зарегистрирована полиплоидная клетка с хромосомным набором, превышающим триплоидный (n = 47). Вероятно, это была тетраплоидная пластинка, понесшая потери. Подобное отклонение от нормы у P. ridibundus регистрировалось и описывалось ранее другими авторами (Günther, 1975; Манило, Радченко, 2010).
Проведенный с помощью U-критерия Манна-Уитни анализ различий между выборками гибридов и особей родительского вида по количеству нормальных клеток (с количеством бивалентов равным тринадцати) показал, что отличие этих выборок является значимым (p = 0,0015). Отчетливо видно (рис. 5), что средняя доля нормальных сперматоцитов от их общего количества для изученных особей P. ridibundus (0,86) более, чем в полтора раза превышает таковую для P. esculentus (0,51), причем диапазон изменений этой доли у особей съедобных лягушек значительно шире. В целом доля нормальных сперматоцитов I среди всех изученных пластинок P. ridibundus составила 0,75, а для P. esculentus — 0,40. Более низкая общая доля нормальных клеток P. ridibundus среди изученных нами клеток (0,75) отличается от средней доли таких клеток, установленных нами для этого вида (0,86). Это отличие является следствием того, что мы более тщательно исследовали особей родительского вида с повышенной частотой аномалий в кариотипах: от каждой такой особи мы изучили большее количество клеток.
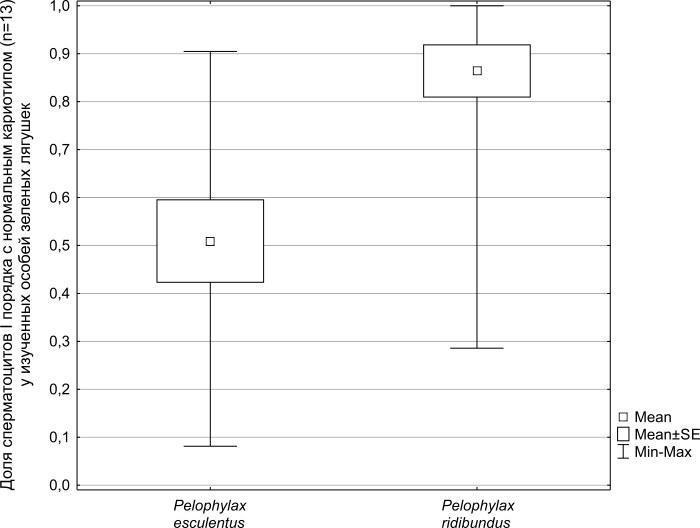
Рис. 5. Cредние значения и доверительные интервалы долей сперматоцитов I порядка c нормальным количеством бивалентов (n = 13).
Fig. 5. Mean values and confidence intervals of spermatocytes I with a normal amount of bivalents (n = 13) share.
На рисунке 6 показано распределение частот встречаемости сперматоцитов I порядка с определенным числом бивалентов. Хорошо видно, что встречаемость клеток с неправильным количеством бивалентов существенно выше для P. esculentus. При этом пределы, в которых изменяется количество структур в сперматоцитах, у съедобных лягушек несколько шире, чем у озерных. Вероятно, значительная доля таких аномальных клеток на последующих этапах сперматогенеза отсеивается. Возможно, впрочем, что часть этих клеток может пройти все стадии гаметогенеза, давая начало анеуплоидным сперматозоидам. Интересно также наличие небольшого пика у P. esculentus для n = 26. Это означает, что в семенниках диплоидных гибридов образуется некоторое количество тетраплоидных клеток, которые затем могли бы привести к образованию диплоидной спермы. Несмотря на более чем десятилетнюю историю изучения Северско-Донецкого центра разнообразия зеленых лягушек, до сих пор остается невыясненным вопрос, в результате каких скрещиваний в нем возникают триплоидные P. esculentus. Образование диплоидными гибридными самцами диплоидной спермы является одним из потенциальных объяснений феномена появления триплоидов.
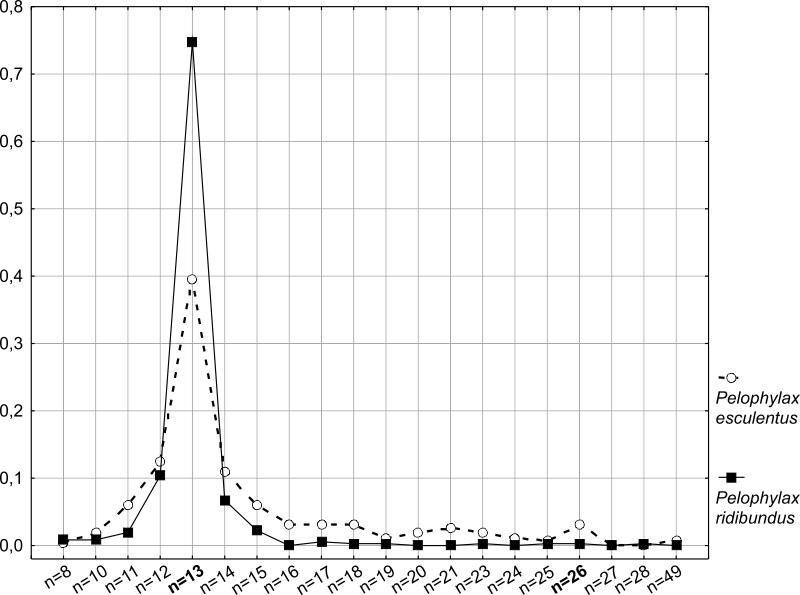
Рис. 6. Распределение частот встречаемости различных наборов бивалентов во всей изученной совокупности клеток P. ridibundus и P. esculentus.
Fig. 6. The arrangement of different bivalent sets frequencies of occurrence in the totality of P. ridibundus and P. esculentus cells studied.
Таким образом можно заключить, что гемиклональность у межвидовых гибридов зеленых лягушек является менее устойчивым механизмом наследования, чем образование рекомбинантных гамет, характерное для представителей родительских видов. Относительная неустойчивость гаметогенеза гибридов должна приводить к снижению эффективности их воспроизводства. Однако следует принять во внимание, что, даже с учетами описанных аномалий, гемиклональное наследование как естественно возникающий способ преодоления гибридной стерильности обеспечивает масcовое воспроизводство P. esculentus при скрещивании с родительскими видами.
По мнению авторов, апробированный в этой работе методический подход нуждается в применении к более широкому материалу. Желательно оценить долю аномалий в ходе сперматогенеза у другого родительского вида, P. lessonae. Интерес представляет выяснение того, как соотносится уровень аномалий при сперматогенезе у гибридов F1, возникающих от скрещивания родительских видов, и у гибридов, передававших клональный геном в значительном количестве поколений. Можно предположить, что уровень аномалий гаметогенеза у родительских видов, обитающих в ГПС вместе с гибридами, будет отличаться от такового у представителей того же вида, происходящих из обычных моновидовых популяций, и не контактирующих с гибридами.
Бондарева А.А., Бибик Ю.С., Самило С.М., Шабанов Д.А. Цитогенетические особенности эритроцитов зеленых лягушек из Северско-Донецкого центра разнообразия Pelophylax esculentus complex // Вісник Харківського національного університету імені В.Н. Каразіна. Сер. біологія. — 2012. — Вип.15, № 1008. — С. 116–123. — http://batrachos.com/Бондарева_2012_Цитогенетические
Боркин Л.Я., Зиненко А.И., Коршунов А.В. и др. Массовая полиплоидия в гибридогенном комплексе Rana esculenta (Ranidae, Anura, Amphibia) на Востоке Украины // Мат. I конф. Українського Герпетологічного Товариства. — К.: Зоомузей ННПМ НАНУ, 2005. — С. 23–26. — http://batrachos.com/Боркин_др_2005_Полиплоидия
Вегерина А.О., Мелешко Е.В., Пырина И.С. и др. Определение соотношения диплоидов и триплоидов среди метаморфов зеленых лягушек в Cеверско-Донецком центре разнообразия Pelophylax esculentus complex // Вісник Харківського національного університету імені В. Н. Каразіна. Сер. біологія. – 2013. — Вип.18, № 1079. — С. 107–113. — http://batrachos.com/Вегерина_др_2013_Метаморфы.
Манило В.В., Радченко В.И., Коршунов А.В. Исследование кариотипа съедобной лягушки (Rana kl esculenta) из Харьковской области Украины // Наук. вісник Ужгород. ун–ту. Сер. Біологія. — 2007. — Вип. 21. — С. 68–73.
Манило В.В., Радченко В.И. Кариологическое исследование Pelophylax ridibundus (Anura, Amphibia) восточной части Украины // Збірник праць Зоологічного музею. — 2010. — № 41 — С. 111–121.
Михайлова О.В., Кечеджи А.Е., Шабанов Д.А. Изучение сперматогенеза у диплоидных Pelophylax esculentus (Amphibia, Anura) при помощи кариоанализа в раздавленных препаратах // Праці Українського герпетологічного товариства. — 2011. — № 3. — С. 120–127. — http://batrachos.com/Михайлова_др_2011_Сперматогенез_диплоидов
Михайлова О.В, Усова О.Є., Шабанов Д.А. Як оцінити популяційний вантаж, що пов'язаний з геміклональною гібридизацією в популяційних системах Pelophylax esculentus complex? // Біологія та валеологія. — Вип. 13 — Харків : ХДПУ, 2011. — С. 44–50.
Морозов-Леонов С.Ю., Межжерин С.В., Некрасова О.Д. и др. Наследование родительских геномов гибридной формой Rana “esculenta” (Amphibia, Ranidae) / // Генетика. — 2009. — Том 45, № 4. — С. 488–495.
Сурядная Н. Н. Материалы по кариологии зеленых лягушек (Rana ridibunda, Rana lessonae, Rana esculenta) с территории Украины // Вестн. зоол. — 2003. — 37, № 1. — С. 33–40.
Шабанов Д.А., Зиненко А.И., Коршунов А.В. и др. Изучение популяционных систем зеленых лягушек (Rana esculenta complex) в Харьковской области: история, современное состояние и перспективы // Вісник Харківського національного університету ім. В.Н. Каразіна. Серія: Біологія. — 2006. — Вип.3, №729. — С. 208–220.
Шабанов Д.А., Литвинчук С.Н. Зеленые лягушки: жизнь без правил или особый способ эволюции? // Природа. — 2010. — № 3 (1135). — С. 29–36. — http://batrachos.com/Лягушки
Dedukh D., Mazepa G., Shabanov D. et al. Optional endoreplication and selective elimination of parental genomes during oogenesis in diploid and triploid hybrid european water frogs // Plos One. — 2015. — 10, N 4. — P. 1–19.
Berger L. Is Rana esculenta lessonae Camerano a distinct species? // Ann. Zool. PAN. — 1964. — 22, N 13. — P. 245–261.
Berger L. European green frogs and their protection. — Poznan : Fundacja Biblioteka Ekologiczna, 2008. — 72 p.
Birstein V.J. Localization of NORs in karyotypes of four Rana species // Genetica. — 1984. — N 64. — P. 149–154.
Günther R. Untersuchungen der meiose bei mänchen von Rana ridibunda Pall., Rana lessonae Cam. und der bastardform „Rana esculenta“ L. (Anura) // Biologisches Zentralblatt. — 1975. —.94, N 3. — S. 277–294.
Plötner J. Die westpaläarktichen Wasserfrösche. — Bielefeld : Laurenti-Verlag, 2005. — 161 S.
Schmid M. Analysis of the Structure and Variability of NORs in Anura // Chromosoma. — 1982. — N 87. — P. 327–344.
Tunner H. G. Die Klonale Struktur einer Wasserfroschpopulation // Z. zool. Syst. und Evolut.-forsch. — 1974. — 12, N 4. — S. 309–314.
Tunner H.G., Heppich-Tunner S. Genome Exclusion and Two Strategies of Chromosome Duplication in Oogenesis of a Hybrid Frog // Naturwissenschaften. — 1991. — 78. — P. 32–34.
Vinogradov A.E., Borkin L.J., Günther R., Rosanov J.M. Genome elimination in diploid and triploid Rana esculenta males: cytological evidence from DNA flow cytometry // Genome. — 1991. — 33. — P. 619–627.