Ядроподобные тельца в гониальных клетках головастиков Rana esculenta (Amphibia, Anura) – возможные пути элиминации хромосом
Maria Ogielska
Nucleus-like bodies in gonial cells of Rana esculenta (Amphibia, Anura) tadpoles - a putative way of chromosome elimination. Zoologica Poloniae (1994) 39/3-4: 461-474.
Department of General Zoology. Zoological Institute, University of Wroclaw, Sienkiewicza 21, 50-335 Wroclaw, Poland
Резюме
Rana esculenta является естественным гибридогенетическим гибридом двух родительских видов R. lessonae и R. ridibunda. Ввиду особого гибридогенетического размножения оба пола производят гаметы, несущие гаплоидный набор хромосом одного из родительских геномов, в то время как другой набор элиминируется перед мейозом. Для того, чтобы обнаружить пути элиминации хромосом, гонады головастиков (и гибридных, и родительских форм), т.е. те стадии, когда клетки наиболее активно пролиферируют, изучали с помощью электронной, световой и флуоресцентной микроскопии. Из двух путей элиминации хромосом: постепенной потери в процессе митозов и отпочковывания от интерфазного ядра с образованием ядроподобных телец (NLB), последний кажется более вероятным.
Введение
Съедобная лягушка, Rana esculenta, является гибридом, геном которого состоит из гаплоидных наборов родительских видов R. lessonae и R. ridibunda (BERGER 1983, GRAF and POLLS-PELAZ 1989). R. esculenta обычно встречается в популяциях с одним из родительских видов. Смешанные популяции esculenta-lessonae являются наиболее распространенными и устойчивыми; их генетическая система называется E-L-системой (UZZELL and BERGER 1975). Индивиды R. esculenta такой системы обычно передают в гаметах только гаплоидный набор хромосом озерной лягушки, в то время как набор прудовой удаляется в процессе гаметогенеза. Гибриды передают из поколение в поколение геном того родительского вида, который отсутствует в популяции. Такой тип размножения называется гибридогенетическим (SCHULTZ 1969, TUNNER 1974).
Наши недавние результаты (OGIELSKA and WAGNER 1993, WAGNER and OGIELSKA 1993) показали, что развитие и дифференциация яичников у R. esculenta является более длительным и поздним процессом по сравнению с таковым у родительских видов (OGIELSKA arid WAGNER 1990, WAGNER and OGIELSKA 1990). В частности, оттягивание начала мейоза и пролонгированная стадия деления оогониев являются наиболее заметными чертами развития яичников гибридов. Более того, в цитоплазме оогониев гибридов были описаны характерные структуры, названные ядроподобными тельцами (NLB). NLB не были обнаружены ни у родительских видов, ни у Xenopus laevis (AL-MUKHTAR and WEBB 1971, COGGINS 1972) и Rana pipiens (MERCHANT-LAROIS and VILLALPANDO, 1981), единственных бесхвостых амфибий, для которых проводились ультраструктурные исследования дифференциации гонад головастиков. Целью работы было обнаружение морфологических маркеров элиминируемых хромосом в зародышевой линии клеток во время ранних стадий дифференциации гонад у головастиков гибридов.
Материалы и методы
Использованные в исследовании головастики были получены в результате скрещиваний, проведенных в лабораторных условиях. Самки были стимулированы путем введения гомогенизированного свежего или замороженного лягушачьего гипофиза. Яйцеклетки были искусственно оплодотворены по RUGH (1965). Самцы и самки R. esculenta и R. lessonae были пойманы в естественных смешанных E-L-популяциях в окрестностях Вроцлава, Польша (Kotowice, Zakrzow, Paniowice). Головастики R. ridibunda и родительские особи были пойманы в окрестностях Познани, Польша и любезно предоставлены LESZEK BERGER and MARIUSZ RYBACKI (ПОЛЬСКАЯ АКАДЕМИЯ НАУК В ПОЗНАНИ).
Изучали потомство следующих скрещиваний:
7 скрещиваний esculenta x lessonae (EL)
2 скрещивания ridibunda x lessonae (RL)
1 скрещивание lessonae x ridibunda (LR)
и контрольных скрещиваний:
5 скрещиваний lessonae x lessonae (LL)
3 скрещивания ridibunda x ridibunda (RR).
Головастиков изучали, начиная со стадии 25 (питающийся головастик) до стадии 46 (окончание метаморфоза), согласно GOSNER (I960). Головастиков содержали в пластиковых контейнерах и кормили вареным салатом и рыбьим кормом. На каждой 2-5-ой стадии индивидов от каждого скрещивания подвергали микроскопическому анализу. Также были протестированы несколько ювенильных особей (1 и 1,5 года).
Для электронной микроскопии у головастиков вырезали гонады и фиксировали в 2,5% глутаральдегиде в 0,1 М фосфатном буфере, рН 7,4, а затем в 1% 0s04 или смеси (1:1) 2% 0s04 с 1% ферроцианидом натрия (MCDONALD 1984).
Для цитохимического исследования ДНК на парафиновых срезах, зафиксированных в глутаральдегиде, формальдегиде или параформальдегиде, использовали метод окрашивания по Фёльгену и флуоресцентное DAPI-окрашивание.
Серии срезов в парафине, толщиной 5-7 мкм, окрашивали Fe-гематоксилином после фиксирования по Ценкеру или Хелле и использовали для анализа митоза.
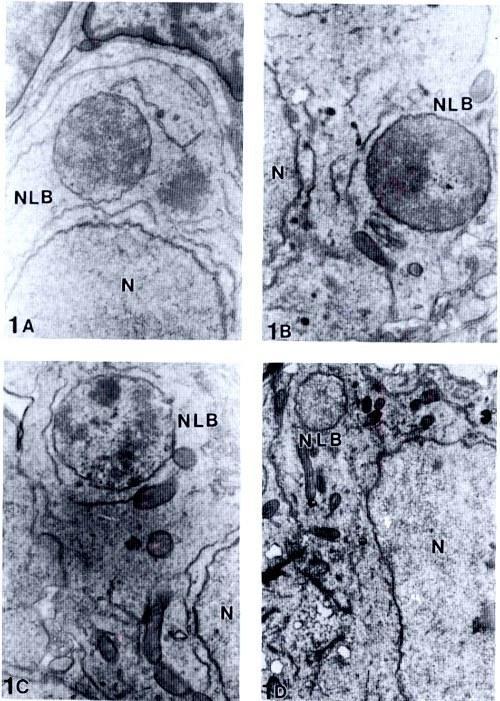
Рис. 1. Ядроподобные тельца в клетках гонад головастиков Rana esculenta. NLB – Ядроподобное тельце, N – ядро. А-С 11000х. D 6600 x
Результаты
I. Ядроподобные тельца (NLB)
В процессе анализа ультраструктуры клеток зародышевого пути гонад головастиков в цитоплазме гониальных клеток были обнаружены сферические тельца диаметром 1,5-3,0 мкм. Эти тельца (NLB) были окружены двойной мембраной и содержали материал, похожий на ядерный хроматин (рис. 1 A-D). NLB были обнаружены на разном расстоянии от «основного» ядра. Под электронным микроскопом эти тельца никогда не обнаруживались у родительских видов: R. ridibunda и R. lessonae. NLB наблюдались в интерфазных гониальных клетках (как оогониях, так и сперматогониях), начиная со стадии 28 развития головастика, когда начинается половая дифференциация. NLB не обнаруживались в недифференцированных гонадах (стадии 25-27).
Самая высокая встречаемость NLB зарегистрирована в гонадах (как семенниках, так и яичниках) на стадиях 28-41, т.е. между 30-м и 80-м днем после оплодотворения. У некоторых особей количество NLB было высоким на момент фиксации, в то время как у других – низким, или же NLB вообще отсутствовали. Во время метаморфоза (стадии 42-46) NLB также обнаруживались, но не так часто, как на ранних стадиях. Они наблюдались только в интерфазных клетках как отдельные сферические тельца, расположенные на разных расстояниях между ядром и клеточной мембраной. Некоторые фотографии, сделанные под электронным микроскопом, позволяют реконструировать предполагаемый путь их образования: ядерная мембрана формирует выпячивание, и сначала внутренняя, а затем и внешняя мембраны сливаются. Следующим шагом является отделение NLB от «основного» ядра (рис. 2 A-D и II). В нескольких случаях атипичные NLB наблюдались у головастиков на стадиях 35-36.
Окрашивание DAPI и по Фёльгену серии срезов в парафине показали наличие ДНК в небольших сферических тельцах в цитоплазме гониальных клеток (рис. 3 и 4). Количество таких телец составляло 1-3 на клетку. В гонадах гибридов зародышевые клетки с тельцами были многочисленными. Неожиданно, такие клетки также иногда обнаруживались в гонадах родительских видов, хотя их количество было мало.
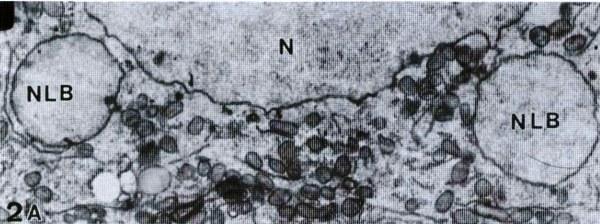

Рис. 2. Реконструкция предполагаемого пути формирования NLB в интерфазных ядрах головастиков Rana esculenta на стадиях 29-31. А – Малое увеличение (2300х) оогония с двумя NLB. В – Формирование выпячивания «основного» ядра (N). Внешняя мембрана уже слилась. 19200х. С – Увеличенный фрагмент одного из NLB с рис. 2А. Обратите внимание на состояние «основного» ядра (N), отмеченное стрелкой. 16000х. D – NLB, отделенное от ядра. Обратите внимание на двойную мембрану между ядром и тельцем (стрелка). 22400х. Е – Нестандартное NLB, возможно, разрушающееся. 16000х.
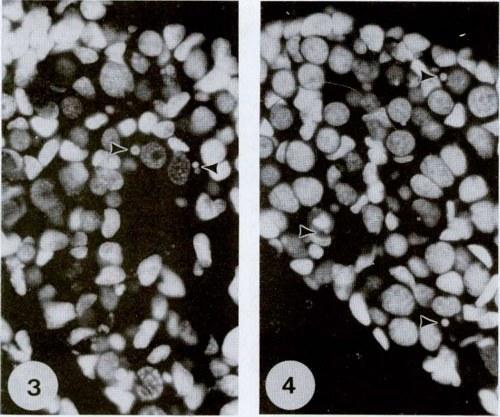
Рис. 3 и 4. Окрашивание DAPI яичника (рис. 3) и семенника (рис. 4) на стадии 31 головастиков Rana esculenta. В гониальных клетках имеется круглое ядро и более диспергированный хроматин, чем в соматических клетках. Стрелки указывают на маленькие сферические тельца, содержащие ДНК. 700х.
2. Митотическое деление гониальных клеток.
Одним из возможных путей удаления хромосом может быть их постепенная элиминация из клетки в процессе последовательных митотических делений. Такая возможность была принята во внимание, и на сериях срезов в парафине были проанализированы распределения хромосом во время ана- и телофаз. Другой путь – элиминация за один шаг во время одного митотического деления путем формирования униполярного веретена деления. Эта возможность была подтверждена анализом формы веретена деления. Первое митотическое деление наблюдали в примордиальных зародышевых клетках (PGC) зачатков гонад голвастиков на поздней стадии 25 (рис. 5). Самая высокая интенсивность митозов у родительских видов наблюдалась на стадиях 26-29 ( рис. 6, 7, 8), а у гибридов – на стадиях 29-41. Все митотические веретена, как у родительских видов, так и у гибридов, были биполярными, униполярных веретен обнаружено не было.
До стадии 28 (недифференцированные гонады) митозы у гибридов регулярны и никаких различий между родителями и гибридами не обнаружено. С началом половой дифференциации гонад гибридов (стадии 28-29) иногда наблюдаются анафазы и телофазы с единичными хромосомами, неправильно распределенными в веретене (рис. 9 A-D, 10 А, В).
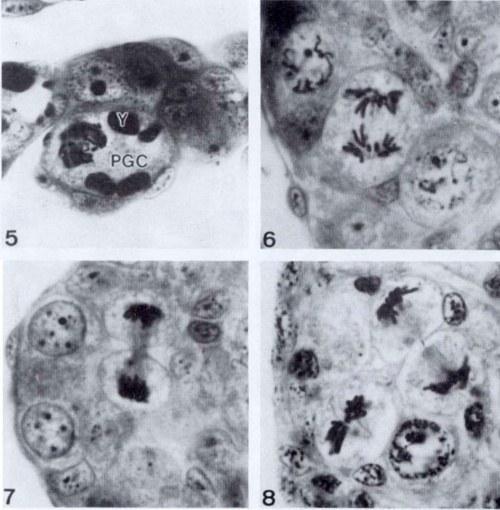
Рис. 5-8. 5. Профаза примордиальной зародышевой клетки (PGC) зачатка гонады головастика поздней стадии 25. Y – желточная пластинка. 1150х. 6, 7 и 8. Митозы сперматогониев на стадиях 29 и 33 головастиков Rana lessonae. 1150х.
Чем позже стадия, тем более многочисленны ненормальные митозы, хотя нормальные всегда составляют большинство. У гибридных самок митозы оогониев также наблюдаются после метаморфоза, что нехарактерно для родительских видов. После стадии 35 у R ridibunda и стадии 33 R. lessonae количество оогониев быстро сокращается, и яичники состоят из все большего количества клеток на стадии диплотены. У гибридов ооциты на фазе диплотены отсутствуют либо их мало, и большая часть коры яичника состоит из оогониев. Митотическую активность в семенниках после метаморфоза не анализировали.
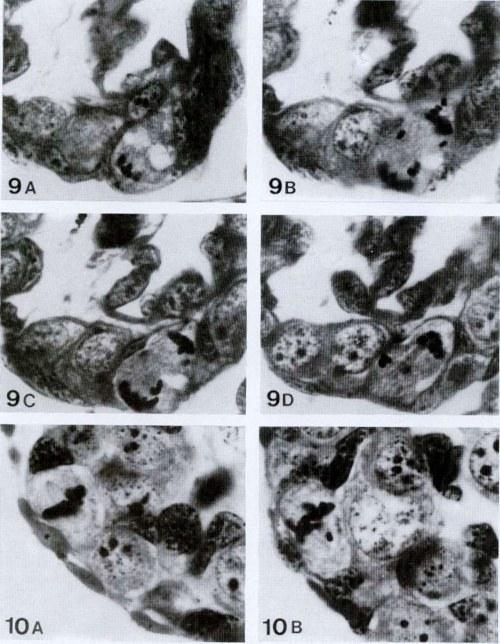
Рис. 9-10. 9. A-D. Неправильная биполярная телофаза оогония на стадии 20 головастика Rana esculenta, видимая на трех последовательных срезах (В и С – одинаковые срезы при разных фокусированиях). 1150х; 10. А и В. Биполярный митоз оогония на стадии 30 головастика Rana esculenta с одной хромосомой вне метафазной пластинки. 1150х.
Обсуждение
Модель гибридогенеза, предложенная TUNNER (1974), хотя и хорошо объясняет генотипы потомства R. esculenta, не была подтверждена цитологическими данными об элиминации одного из хромосомных наборов. В 1973 г. GONTHER описал сперматогенез у взрослых самцов R. esculenta, но не обнаружил никаких признаков элиминации хромосом. С другой стороны, HEPPICH et al. (1982) and BUCCI et al. (1990) показали, что пролиферирующие сперматогонии взрослых самцов R. esculenta содержат только хромосомы R. ridibunda. Однако, VINOGRADOV et al. (1990) обнаружили несколько взрослых самцов R. esculenta, в чьих сперматогониях были геномы обоих родительских видов.
Похожие результаты были получены для взрослых самок. Экспериментальный гиногенез (развитие яйцеклетки без мужского пронуклеуса) ооцитов R. esculenta привел к получению ридибундового потомства (GRAF and MULLER, 1979), а цитоплазма ооцитов R. esculenta на стадии диплотены содержала продукты трансляции генов R. ridibunda (CHEN and STUM-ZOLLINGER, 1986). Недавно BUCCI et al. (1990) описали биваленты ооцитов R. esculenta на стадии диплотены, состоящие из двух ридибундовых хромосом.
Вышеизложенные данные показывают, что элиминация хромосом R. lessonae должна происходить на ранних стадиях развития и до мейоза, как было впервые предположено UZZELL et al. (1980). TIJNNER and HEPPICH (1981) и TUNNFR and HEPPICH-TUNNER (1991) разработали технику двойного окрашивания fluorescence lioechst-Actinomycin D, которая позволяет отличать ридибундовые и лессоновые хромосомы. Они исследовали самок R. esculenta незадолго до метаморфоза, когда все еще имеются делящиеся оогонии, и описали три класса оогониев: диплоидные ридибундовые, гаплоидные ридибундовые и анеуплоидные с доминирующими ридибундовыми хромосомами. Похоже, что элиминация лессоновых хромосом была постепенной и, возможно, началась на ранних стадиях развития. Подробные исследования развития яичника у R. ridibunda, R. lessonae и R. esculenta показали, что интенсивная пролиферация оогониев у родительских видов заканчивается перед метаморфозом (стадия 42), тогда как у гибридов этот процесс наблюдался и после метаморфоза (OGIELSKA and WAGNER, 1990, 1993; WAGNER and OGIELSKA 1990, 1993). Более того, трансформация оогониев в ооциты задерживалась и у большинства ювенильных самок не было ооцитов на стадии диплотены. Эти данные соответствуют встречаемости NLB: они обнаруживались на стадиях 29-41, но также до и после метаморфоза, т.е. на тех стадиях, для которых TUNNER and HEPPICH (1981) and TUNNER and HEPPICH-TUNNER (1991) описали постепенную потерю лессоновых хромосом клетками зародышевой линии. Эти данные позволяют предположить, что NLB могут быть носителями удаляемых хромосом.
NLB также обнаруживали в сперматогониях во время ранних стадий развития семенника у головастиков. Исследования сперматогенеза были проведены HEPPICH et al. (1982) and Bucci et al. (1990), но они касались только взрослых самцов. Генотип сперматогониев взрослых особей был исключительно ридибундовым. Это позволяет предположить, что лессоновые хромосомы во время сперматогенеза удаляются только до или сразу после метаморфоза. Однако, нет подробных работ по сперматогенезу и развитию семенников.
Во время анализа с помощью электронной микроскопии NLB обнаруживали только у головастиков R. esculenta и никогда у родительских видов. С другой стороны, цитохимический анализ с использованием световой микроскопии показал наличие небольших сферических тел, содержащих ДНК, в гониальных клетках родителей. Если NLB и DAPI-содержащие тельца являются одними и теми же структурами, мы должны рассматривать возможность того, что родительские виды также способны выбрасывать хромосомы из зародышевых клеток, хотя этот феномен является редким. Это может рассматриваться как эволюционная основа для гибридогенеза у гибридов: гибридогенез возможен, т.к. родительские виды имеют цитологические механизмы удаления хромосом.
Главный вопрос в этом исследовании, требующий ответа, – каким образом хромосомы удаляются из зародышевой линии. Для обсуждения приняты два возможных пути, схематически показанных на рис. 12:
1. Элиминация хромосом происходит во время интерфазы. Возможный механизм – разновидность ферментативной деградации хроматина, который затем удаляется из интерфазного ядра в виде NLB. Эта гипотеза подтверждается схожесть. NLB и структур, наблюдаемых во время апоптоза (программированной клеточной смерти) (см. CLARKE, 1990). Такой вероятный путь также был упомянут в работах VINOGRADOV et al. (1990).
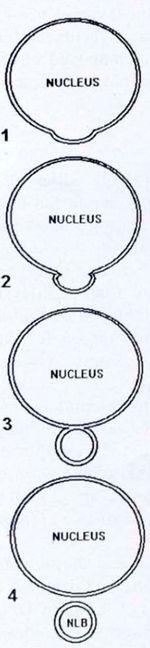
Рис. 11. Формирование NLB путем отпочковывания от интерфазного ядра гониальной клетки. См. также рис. 2 A-D
2. Элиминация хромосом происходит во время митоза. Эта гипотеза подтверждается многочисленными мета-, ана- и телофазами, в которых отдельные хромосомы неправильно распределялись в веретене деления. Такие единичные хромосомы (или хромосомные фрагменты) могут формировать свою собственную ядерную оболочку, что является характерным для хроматина, появляющегося в цитоплазме, например, в случае ДНК вирусов, введенной в цитоплазму яйцеклетки (FORBES et al., 1983, SHIOKAWA et al. 1987), проникающего в яйцеклетку пронуклеуса сперматозоида, который реконструирует свою оболочку перед слиянием (LONGO and ANDERSON 1968) или в случае кариомеров, когда отдельные хромосомы формируют собственную ядерную оболочку во время телофазы (ITO ET AL., 1981). То же происходит и у рыб Hydrolagus colliei, для которых описано уменьшение количества хромосом в сперматогониях (STANLEY et al. 1984). У гибридных R. esculenta это может быть, однако, вторичным эффектом уменьшения количества интерфазных хромосом при последующих клеточных делениях. Сложно сказать, какая из двух гипотез верна. Однако, согласно морфологическим особенностям, первая кажется более вероятной.
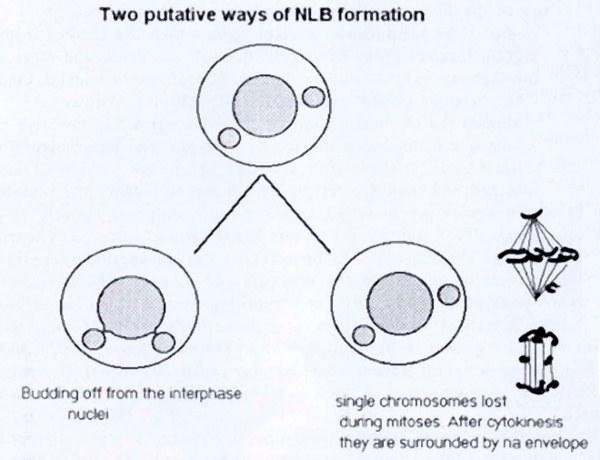
Рис. 12. Два предположительных пути формирования NLB
Каким бы ни был путь удаления хромосом (уменьшение количества), этот феномен в общем редок для клеток зародышевой линии. Среди позвоночных он известен у рыб Poeciliopsis lucida-moncicha (CIMINO, 1972) и Hydrolagus colliei (STANLEY et al. 1984). P. lucida-monacha формируют диплоидные популяции самок, для которых описан гибридогенез (SCHULTZ, 1969). Во время митозов оогониев наблюдали единоразовую элиминацию родительских хромосом. Ее цитологический механизм включает формирование униполярного веретена деления, к которому присоединены только материнские хромосомы, в то время как отцовский набор хромосом остается в цитоплазме. Во время сперматогенеза H. colliei часть хромосом удаляется в метафазе І. Компактная масса удаляемых хромосом не включается в ядро, но формирует отдельные тельца (CDC – chromatin diminution body), окруженные двойной клеточной мембраной. CDC остается в цитоплазме одной из дочерних клеток до стадии сперматид, а затем перемещается в цитоплазму клетки Сертоли, где и разрушается.
R. esculenta третий известный вид позвоночных, для которых описано уменьшение количества хромосом. И R. esculenta,и P. lucida-monacha размножаются путем гибридогенеза, а H. colliei не имеет специфического типа размножения, и роль CDC остается неизвестной.
У беспозвоночных также описано уменьшение количества хромосом в зародышевой линии. Во время сперматогенеза Sciara coprofila отцовские хромосомы элиминируются в цитоплазму в метафазе І. Они остаются гетерохроматизированными, а затем удаляются из клетки. Только материнские хромосомы остаются прикрепленными к митотическому униполярному веретену (METZ, 1933, ABBOT et al. 1981). Другой пример – Metaseiulus occidentalis (Acarina), у которых удаляемые во время сперматогенеза отцовские хромосомы сначала гетехроматинизируются внутри ядра, а затем элиминируются из клетки (NELSON-REES et al., 1980). Недавно гибридогенез и элиминация генома были описаны для некоторых популяций палочников Bacillus rossius - grandii henazzi с Сицилии (TINTI and SCALI, 1992). В этом случае один из родительских хромосомных наборов подвергается гетерохроматинизации перед метафазой І, затем перемещается в полярное тельце и элиминируется.
Ни формирование униполярного веретена, ни гетерохроматинизация хромосом не наблюдались у исследуемых R. esculenta. Наиболее вероятный путь удаления одного хромосомного набора – формирование NLB во время интерфазы. Однако, механизм этого феномена остается неразгаданным.
REFERENCES
ABBOT, A.G., HEES, J.E. and GERBI. S.A., 1981: Spermatogenesis in Sciara coprophilq. I. Chromosome orientation on the monopolar spindle of meiosis I. Chromosoma, 83: 1-18.
AL-MUKHTAR, K.K. and WLBB, A.C., 1971: An ultrastructural study of primordial germ cells, oogonia and early oocytes in Xenopus laevis. J. Embryol. exp. Morph., 26: 195-217.
BERGER, L., 1983: Western palearctic frogs (Amphibia, Ranidac): systematics, genetics and population composition. Experientia, 39: 127-130.
BUCCU S., RAGGHIANTI, M., MANCINO, G., BERGBR, L., HOTZ, H. and UZZELL, Т., 1990: Lampbrush and mitotic chromosomes of the hemiclonally reproducing hybrid Rana esculenta and its parental species. J. exp. Zool., 255: 37-56.
CHEN, P.S. and STUMM-ZOLLINGER, E., 1986: Patterns of protein synthesis in oocytes and early embryos of Rana esculenta complex. Roux's Arch. Dev. Biol., 195: 1-9.
CIMINO, M.C., 1972: Egg-production, polyploidization and evolution in a diploid all-female fish of the genus Poeciliopsis. Evolution, 26: 294-306.
CLARKE. P.G.H., 1990: Developmental cell death: morphological diversity and multiple mechanisms. Anat. Embryol., 181:195-213.
COGGINS, L.W., 1973: An ultrastruciural and autoradiographic study of early oogenesis in the toad Xenopus laevis. J. Cell Science, 12: 71-93.
FORBES, D.J., KIRSCHNER, M.W. and NEWPORT, J.W., 1983: Spontaneous formation of nucleus-like structures around bacteriophage DNA microinjected into Xenopus eggs. Cell, 34: 12-23.
GOSNER, K.L., I960: A siplified table for staging anuran embryos with notes of their identification. Herpetologia, 16: 183-190.
GRAF, J-D. and MULLER, W.P., 1979: Experimental gynogenesis provides evidence of hybridogenetic reproduction in the Rana esculenta complex. Experientia, 35: 1574-1576.
GRAF, J-D. and POLLS-PELAZ, M., 1989: Evolutionary genetics of the Rana esculenta complex. In: Evolution ane ecology of unisexual vertebrates. Ed. R.M. Dawley and J.P. Bogart, Bulletin 466, New York State Museum, Albany, N. York, USA, pp. 289-301.
GUNTHER, R., 1973: IJber die verwandtschaftlichen Beziehungen zwischcn den europaisschen Grunfroschen und dem bastardcharakter von Rana esculenta L. (Anura). Zool. Anz., Leipzig, 190: 250-285.
HEPPICH, S., TUNNER, H.G. and GRFJLHUBFR, J., 1982: Premeiotic chromosome doubling after genome elimination during spermatogenesis of the species hybrid Rana esculenta. Theor. Appl. Genet., 61: 101-104.
ITO, S., DAN, K. and GOODENOUGH, D., 1981: Ultrastructure and lP-thymidyne incorporation into chromosome vesicles in sea urchin embryos. Chromosoma, 83: 441- 453.
LONGO, F.J. and ANDERSON, E., 1968: The fine structure of pronuclear development and fusion in the sea urchin Arbacia punctata. J. Cell Biol., 39: 339-368.
MCDONALD, K., 1984: Osmium ferrocyanide fixation improves microfilament preservation and membrane visualization in a variety of animal cell types. J. Ultr. Res., 86: 107-108.
MERCUAND-LAROIS, П., VILLALPANDO, I., 1981: Ultrastructural events during early gonadal development in Rana pipiens and Xenopus laevis. Anat. Rec., 199: 349- 360.
METZ, C.W., 1933: Monocentric mitosis with segregation of chromosomes in Sciara and its bearing on the mechanisms of mitosis. Biol. Bull., 64: 333-347.
NELSON-REES, W.A., HOY. M.A. and ROUSH, R.T., 1980: Heterochroma-tinization, chromatin elimination and haploidization in the parahaploid mite Metaseiulus occidentalis (Nesbitt) (Acarina: Phytoseiidae). Chromosoma, 77: 263-276.
OGIELSKA, M. and WAGNER, E., 1990: Oogenesis and development of the ovary in European green frog, Rana ridibunda (Pallas). I. Tadpole stages until metamorphosis. Zool. Jb. Anat., 120: 211-221.
OGIELSKA, M. and WAGNER, E., 1993: Oogenesis and ovary development in the natural hybridogenetic water frog, Rana esculenta L. 1. Tadpole stages until metamorphosis. Zool. Jb. Physiola., 97: 349-368.
SHIOKAWA, K.. TASHIRO, K., YAMANA, K. and SAMESHIMA, M., 1987: Electron microscopic studies of giant nucleus-like structures formed by DNA introduced into the cytoplasm of Xenopus laevis fertilized eggs and embryos. Cell Diff., 20: 253-261.
STANLEY, H.P., KASINSKY, H.E. and BOLS, N.C., 1984: Meiotic chromatine diminution in a vertebrate, the holocephalan fish Hydrolagus colliei (Chondrichthies, Holocephali). Tissue and Cell, 16: 203-215.
RUGH, R., 1965: Experimental Embryology. Burges, Minneapolis.
SCHULTZ, JR., 1969: Hybridization, unisexuality and polyploidy in the teleost Poeciliopsis (Poeciliidae) and other vertebrates. Amer. Natur., 103: 605-619.
TINTI, F. and SCALI, V., 1992: Genome exclusion and gametic DAPI-DNA content in the hybridogenetic Bacillus rossius-grandii benazzi complex (Insecta Phasmatodea). Mol. Rep. Dev., 33: 235-242.
TUNNER, H.G., 1974: Die klonale Struktur einer Wasserfroschpopulation. Z. Zool. Evol. Forsch., 12: 309-314.
TUNNER, H.G. and HEPPICH, S., 1981: Premeiotic genome exclusion during oogenesis in the common edible frog, Rana esculenta. Naturwissenschaften, 68: 207- 208.
TUNNER. H.G. and HEPPICH-TUNNER, S., 1991: Genome exclusion and two stratergies of chromosome duplication in oogenesis of a hybrid frog. Naturwissenschaften, 78: 32-34.
UZZELL, Т., HOTZ, H. and BERGER, L. 1980: Genome exclusion in gametogenesis by an interspecific Rana hybrid: evidence from electrophoresis of individual oocytes. J. exp. Zool., 259: 214-251.
VINOGRADOV, A.E., BORKIN, L.J. and ROSANOV, J.M., 1990: Genome elimination in triploid and diploid Rana esculenta males: cytological evidence from DNA flow cytometry. Genome, 33:619-626.
WAGNER, E. and OGIELSKA, M., 1990: Oogenesis and development of the ovary in European green frog, Rana ridibunda (Pallas). 2. Juvenile stages until adults. Zool. Jb. Anat., 120: 223-321.
WAGNER, E. and OGIELSKA, M., 1993: Oogenesis and ovary development in the natural hybridogenetic water frog, Rana esculenta L. 2. After metamorphosis until adults. Zool. Jb. Physiol., 97: 349-368.
UZZELL, T.M. and BERGER, L., 1975: Electrophoretic phenotypes of Rana ridibunda, Rana lessonae and their hybridogenetic associate, Rana esculenta. Proc. Acad. Nat. Sci. Philadelphia, 127: 13-24.
Коментарі
спасибо интересный материал
спасибо интересный материал