Нобель троицу любит
ХИМИЯ. Какой образ концентрирует в себе страхи обывателя перед новейшими биотехнологиями? Светящееся зловещим светом чудовище. Стэплтон был вынужден мазать собаку Баскервилей составом, содержащим фосфор. Создатели современных монстров куда изощреннее. Они опираются на технологию, фундамент которой заложил в 1961 году Осаму Cимомура (Osamu Shimomura). Японский ученый, к тому времени переехавший в США, изучал механизмы свечения морских животных. Исследуя биолюминесценцию одной из медуз, он выделил белок, ответственный за излучение "живого" света. Этот белок стал первым в группе GFP - зеленых флуоресцирующих белков. При дневном свете он излучал довольно слабый зеленоватый свет, зато ярко светился при облучении ультрафиолетом. Хотя физико-химические механизмы, позволяющие таким белкам захватывать кванты с одной длиной волны, а потом излучать энергию на другой длине, еще недостаточно изучены, применению подобных белков это не мешает.

Многие технологии генной инженерии требуют многократных попыток внедрения нового генетического материала в комплекс наследственной информации трансформируемых организмов. Грубой аналогией применяемой в генетике процедуры может быть попытка улучшить свойства телевизоров путем стрельбы по ним из пушек, заряженных радиодеталями. Как выбрать те клетки, которые изменились в нужном направлении?
Одно из решений нашел в начале 90-х годов прошлого века американский биолог Мартин Чалфи (Martin Chalfie): надо "сшить" ген светящегося белка с тем геном, который интересует исследователей. После обработки культуры клеток на них будет достаточно посветить ультрафиолетом. Те клетки, где заработала чужеродная генетическая информация, засветятся зеленым!
Наконец, еще один американский исследователь китайского происхождения, Роджер Цьен (Roger Tsien), научился использовать не только белки, обеспечивающие зеленое свечение, но и белки иных цветов. Теперь появилась возможность связать в модельном организме светящиеся белки разных цветов с различными генами. Посветив УФ-излучением, можно получить яркую картину, где тот или иной цвет будет маркировать клетки, в которых включаются интересующие исследователя гены! Новый метод стал важнейшим инструментом молекулярно-биологических изысканий, и не случайно его создатели удостоились Нобелевской премии.
Итак, равные доли получат Осаму Симомура (1928 года рождения) из Лаборатории морской биологии в Вудс-Холе, Массачусетс; Мартин Чалфи (1947) из Колумбийского университета и Роджер Цьен (1952) из Калифорнийского университета в Сан-Диего. Российские исследователи тоже приложили руку к новой технологии, но премированы не были. Остается надеяться, что в нобелевской речи лауреаты упомянут Михаила Матца и Сергея Лукьянова, которые первыми нашли белок с красным свечением.
Надо ли обывателю опасаться монстров, "в которых внедрили гены морских медуз"? Когда речь идет о пугающих всех генетически модифицированных организмах, свечение маркирует результаты генетических вмешательств. Однако с чем связаны опасения в отношении новых биотехнологий? С незнанием того, как же в действительности управляется развитие организмов. Лауреаты Нобелевской премии этого года награждены за разработку инструмента, сокращающего наше незнание.
МЕДИЦИНА. Премия по физиологии и медицине присуждена ученым, чьи работы спасают человеческие жизни. Нынешний приз решено разделить на две части. Первая досталась Харальду цур Хаузену (Harald zur Hausen, 1936 года рождения) из Германского центра исследования рака в Гейдельберге за открытие вирусов папилломы человека, вызывающих рак шейки матки.

Проблема рака для нашей стареющей цивилизации становится все острее. Увы, до сих пор мы знаем далеко не все механизмы, приводящие к выходу отдельных клеток организма из-под общего управления. Неконтролируемо делящиеся клетки вызывают опухоль; если они еще и обладают способностью к расселению, такую опухоль называют раковой. Представление о раке как о заразной болезни не подтвердилось, однако для отдельных видов рака вклад вирусов в перерождение клеток может быть весьма велик. Классический пример такого механизма был описан при участии Харальда цур Хаузена в восьмидесятых годах прошлого века.
Каждый двадцатый случай рака в мире - рак шейки матки. Эта болезнь ежегодно уносит жизни более чем двухсот тысяч женщин. Как выяснил нынешний лауреат, в большинстве случаев рак развивается на основе папиллом (некрупных доброкачественных разрастаний), вызываемых специфическими вирусами. Если женщина была заражена одной из двух "нехороших" форм вируса папилломы, вероятность заболевания раком матки для нее резко возрастает. Вирус не вызывает рак сам по себе, но подталкивает процесс его развития. Значит, проводя широкую вакцинацию против вируса папилломы, можно сохранить жизни сотен тысяч людей. Задача эта еще не решена, хотя довольно эффективные вакцины уже разработаны. Может, решение Нобелевского комитета ускорит переход к вакцинации женщин по всему миру?
Вторая половина премии связана с еще более грозным вирусом. Сейчас он известен как ВИЧ, а вызываемое им заболевание - СПИД - погубило уже более 25 миллионов человек. За открытие вируса награждены французские исследователи Франсуаза Барре-Синусси (Franсoise Barrе-Sinoussi, 1947) и Люк Монтанье (Luc Montagnier, 1932). Сейчас Монтанье возглавляет Всемирный фонд исследования и предупреждения СПИДа.
Нобелевская награда возобновила старые споры о приоритете в исследовании ВИЧ. На авторство судьбоносного открытия претендовала также группа Роберта Галло (Robert Gallo), работавшая в Америке. Именно американцам принадлежит патент на методику обнаружения ВИЧ в крови. К сожалению, споры о том, кто был пионером, и борьба патентов задержали развитие исследований СПИДа. Как видно, Нобелевский комитет поддержал версию о приоритете французской группы.
А можно ли, распределяя премии, наградить всех по их действительным заслугам? Вероятно, нет. Минимум, который может быть обеспечен, состоит в том, чтобы все, кто получил награду, ее заслуживали. Увы, о награждении всех достойных говорить не приходится.
Бороться с ВИЧ труднее, чем с вирусом папилломы. Возбудитель СПИДа столь изменчив и так изощренно скрывается в клетках человека, что разработать вакцину от него не удалось до сих пор. Многие авторитеты предполагают, что эффективная вакцина от СПИДа невозможна. Интернет полон откровений сторонников теории заговора, настаивающих, что само существование ВИЧ - выдумка, скрывающая истинные причины болезней. Увы, победа над СПИДом скорее всего далека. Однако уже есть реальные результаты, спасающие множество жизней. Современная антивирусная терапия не уничтожает ВИЧ в крови, но позволяет не допустить развитие СПИДа. И эти, и будущие методики основаны на работах первооткрывателей ВИЧ.
Нобелевский комитет иногда упрекают в том, что он награждает за довольно давние работы. Работы лауреатов этого года хоть и не входят в число последних новостей, связаны с приоритетами современного развития науки.
Большая польза большой науки
Медицина
Как известно, биология (якобы наука XXI века) не удостоилась отдельной Нобелевской премии, и биологи получают награды за открытия в области медицины и физиологии. Впрочем, работа, отмеченная в этом году, имеет прямое отношение именно к медицине. Нынешняя премия попадет в руки троих ученых: американцев Марио Капекки (Mario R. Capecchi [5], 1937 года рождения) и Оливера Смитиса (Oliver Smithies [6], 1925), а также англичанина сэра Мартина Эванса (Martin J. Evans [7], 1941) за разработку способа «введения специфических генных модификаций в организмы мышей с использованием эмбриональных стволовых клеток» или, иначе, за генный нокаут (gene knockout).



Понятно, что лечить болезни нужно, дотягиваясь до самого глубинного уровня регуляции. Если болезнь связана с работой (экспрессией) какого-то гена, нужно этот ген остановить; если включение какого-то гена может вызвать выздоровление, нужно этот ген включить. Какие-никакие способы воздействия на определенные участки генома уже разработаны. Генные тексты - последовательности нуклеотидов в типичных геномах - прочитаны уже для многих видов. По характерным признакам (например, регуляторным фрагментам) в этих последовательностях можно опознать участки, соответствующие отдельным генам. Осталась «малость» - понять, какой ген за что отвечает. Однако задача описания взаимодействия результатов активности генов неизмеримо превосходит по сложности любую из задач, решавшихся человечеством. Но как-то ведь подходить к этой глыбе надо! И вот тут выясняется, что способ, предложенный победителями самого престижного научного конкурса, - лучшее, до чего удалось додуматься современным ученым.
Как узнать функцию какой-то детали в сложной системе? Сломать ее и посмотреть, что изменится! Как сломать ген? Выключить его с помощью методов генной инженерии («ударив» молекулярно-биологическими методами в точку, определенную благодаря расшифровке геномных последовательностей). Как сделать, чтобы интересующий нас ген был выключен во всем организме? Вырубить его в одной клетке, а потом вырастить из нее целый организм. Каким образом? Использовать эмбриональные стволовые клетки. Можно ли это сделать с человеком? Нет, с человеком нельзя, а вот с мышами можно. И основы этой технологии были заложены лауреатами премии около двадцати лет назад.
Итак, получить престижную премию нетрудно. Нужно осознать специфическую технологическую потребность науки на завтрашнем этапе ее развития, придумать способ ее удовлетворения и разработать соответствующие методики.
Трое «именинников» не работали вместе. Капекки интересуют различные формы рака и сердечных нарушений, Смитиса - гипертония и нарушения синтеза гемоглобина, а Эванса - муковисцидоз и рак молочных желез. Однако каждый из них, решая свои задачи, способствовал прогрессу технологий, имевших более широкое применение. Найден целый ряд ключевых точек, ответственных за генезис заболеваний мышей (а значит, с высокой степенью соответствия, и людей). Прорыва в лечении болезней нет, но они неизбежны. И те, кого за такие прорывы когда-нибудь премируют, наверняка будут использовать или генный нокаут, или полученные с его помощью сведения.
Из примерно 20 тысяч генов мыши на сегодня нокаутирована примерно половина. Получена масса ценной информации. Пройдет не так много времени, и будет известен эффект от выключения любого гена по отдельности. Вы думаете, что тогда человечество поймет, как функционирует мышиный геном? Да на это никаких Нобелевских премий не хватит!
Естественно, Америка
Выбор лауреатов Нобелевских премий 2006 года по естественным наукам политкорректностью не отличается. Все пятеро призеров - не только граждане, но и уроженцы США, так что на отток лучших умов в Штаты этот казус не спишешь1. Однако дело вовсе не в проамериканских настроениях шведских научных рефери. Все премии этого года присуждены за действительно фундаментальные, основополагающие исследования стопроцентно нобелевского уровня. Краткое описание отмеченных работ по дисциплинам мы решили построить в том же порядке, в каком они были объявлены Нобелевским комитетом 2–4 октября.
Большая премия за малые РНК
«КТ» не раз сетовала на то, что Нобелевские премии, как правило, вручают состарившимся ученым за открытия, которые давным-давно обосновались в соответствующих учебниках. В этом году Нобелевский комитет поломал эту прискорбную традицию, вручая премию по физиологии и медицине. Около 1,4 млн. долларов поделят молекулярные биологи Эндрю Файер (Andrew Fire) и Крейг Меллоу (Craig Mello), которым нет еще и пятидесяти. Награду они получили за достаточно свежую работу - статью, опубликованную в журнале Nature в 1998 году. У той статьи было шесть авторов, но Файер - первый из них, а Меллоу - последний. Премия присуждена за открытие РНК-интерференции, блокирования работы генов в результате действия малых двухцепочечных молекул РНК - siRNA (small interfering RiboNucleic Acids). Это открытие имеет как важнейшее теоретическое значение, так и впечатляющие практические перспективы. Обсудим открытый феномен подробнее.
Раскрыв учебники, вы узнаете, что РНК играет вспомогательную роль в хранении и передаче генетической информации. Основной информационный поток в клетке идет в направлении от ДНК через РНК к белку. ДНК - устойчивый двухцепочечный носитель информации, а РНК - ее одноцепочечный переносчик. Другие молекулы РНК выступают в роли подносчиков аминокислот или входят вместе с белками в состав рибосом. Передача информации от РНК к ДНК открыта довольно давно, но она казалась какой-то патологией, характеризующей почти исключительно РНК-несущие вирусы (такие, например, как ВИЧ). Данные, свидетельствующие в пользу широкого распространения передачи от РНК к ДНК, известны гораздо меньше, как и факт существования рибозимов - молекул РНК, обладающих каталитической активностью. В любом случае, РНК часто воспринимается как подсобный класс молекул, обслуживающих два «столпа» жизни - ДНК и белки. Основное внимание в исследованиях уделялось достаточно крупным молекулам РНК (так, информационная РНК может состоять из 100 тысяч нуклеотидов), а мелкие молекулы РНК воспринимались как малосущественные осколки больших молекул.
С началом экспериментов по генной инженерии стали накапливаться странные факты. Предположим, желая усилить работу какого-то гена в клетке растения, вы вводите в нее еще одну копию этого гена. Парадоксальным образом это может приводить к противоположному результату: и новый ген не встроится, и старый перестанет работать! Со временем выяснилось, что в таких клетках увеличивается число малых РНК, казавшихся обломками нужного гена. На этом этапе развития науки нынешние нобелевские лауреаты сделали следующее: поняли, что «выключателем» гена является именно малая РНК, и для описания этого феномена ввели понятие РНК-интерференции; исследовали этот процесс у круглого червя Caenorhabditis elegans и, наконец, обнаружили, что наиболее активными являются необычные двухцепочечные молекулы РНК.
Прошло восемь лет. Стало ясно, что siRNA являются мощным защитным средством, охраняющим клетки от вирусов и потенциально опасных элементов собственного генома (мобильных генетических элементов). В ответ на попадание в клетку чужеродного гена его фрагмент каким-то (пока неизвестным) способом преобразуется в siRNA, двухцепочечную молекулу из 21–28 нуклеотидов на цепочку. Эта молекула связывается с какими-то белками, расщепляется на отдельные цепочки, соединяется с соответствующими последовательностями в своих или чужих генах и опять-таки с помощью белков блокирует их работу. Итак, описываемые молекулы являются ключевым звеном сложной (и по большей части еще не изученной) системы управления генной активностью! Разные организмы отличаются по эффективности работы этой системы - для растений или, к примеру, круглых червей, с которыми работали лауреаты, она важнее, чем для млекопитающих, использующих и иные формы иммунной защиты. В общем, еще разбираться и разбираться… Возвращаясь к роли РНК в клетке, можно сказать, что исследования последних лет показывают - этот класс молекул является не вспомогательным, а центральным, интегрирующим основные клеточные процессы.
Применять найденный феномен можно до того, как будет понят его механизм. Сегодня siRNA стали распространенным инструментом для изучения функции генов. Когда речь идет о системе такой сложности, как клетка, наш главный методический подход прост - сломать какую-нибудь детальку и посмотреть, в каком месте засбоит. Останавливаем нормальную работу гена и смотрим, где что поменялось… Ага, вот на эти-то функции ген и влиял… Для такой работы лучшего инструмента, чем siRNA, пока не найдено. Вызывает интерес возможность использования генной интерференции и для борьбы с вирусами. Рабочих технологий блокирования вирусных инфекций введением в клетки соответствующей siRNA пока не создано, но идея кажется перспективной.
Задумавшись о сути научных премий, мы можем заключить, что их предназначение - не просто награждение достойных. Премия должна стимулировать интерес к важным областям исследования. Кажется, нынешняя физиолого-медицинская премия выполняет это предназначение. ДШ <…>
Яблочко от яблони
Нобелевская премия по химии досталась на сей раз одному человеку - профессору структурной биологии Стэнфордского университета Роджеру Корнбергу (Roger D. Kornberg). Кстати, это тот самый случай2, когда известная пословица о том, что «на детях талантов природа отдыхает», неправа. Отец Роджера Артур Корнберг получил премию по медицине и физиологии в 1959 году. В его честь назван фермент, синтезирующий ДНК по ДНКовой матрице - ДНК-полимераза I, она же полимераза Корнберга.
Любопытно и то, что химическая награда 2006 года оказалась тесно связана с медицинской. Первый этап процесса внутриклеточного биосинтеза белков - перезапись генетической информации с ДНК на РНК. В этом процессе, который называется транскрипцией, участвует фермент РНК-полимераза, молекула которого состоит из тридцати тысяч атомов. Если Корнберг-отец работал с ДНК-полимеразой, то Корнберг-сын выбрал РНК-полимеразу. Роберт Корнберг получил премию за фундаментальные исследования, которые привели к гораздо лучшему пониманию механизмов работы этого энзима на молекулярном уровне.
Основные принципы действия РНК-полимеразы были известны и раньше. Этот фермент сначала распознает тот участок ДНК, откуда следует начинать транскрипцию (его называют промотором), вступает с ним во взаимодействие, расплетает двойную спираль ДНК и использует одну из ее нитей как матрицу для строительства РНК. По мере движения участка полимеразы удлиняющаяся цепь РНК отходит в сторону от ДНКовой матрицы, и ДНК восстанавливает свою двухцепочечную структуру.
Это общая схема, но в ее реальном воплощении есть множество нюансов. Как известно, по строению клеток организмы делятся на доядерные (прокариоты) и ядерные (эукариоты), к последним относятся высшие организмы. Как ни парадоксально, мы значительно лучше знаем устройство клеток прокариот (например, знаменитой кишечной палочки - главного объекта молекулярной биологии), нежели устройство клеток животных, растений или грибов. Корнберг-отец работал с кишечной палочкой, а Корнберг-сын - с дрожжами (одноклеточными грибами). Вместе с членами своей группы младший Корнберг разработал элегантную технику экспериментов с эукариотическими дрожжевыми клетками, которая дала много новой информации о процессе транскрипции. Фактически ему удалось полностью описать работу РНК-полимеразы дрожжей на молекулярном уровне, что и принесло Роджеру Корнбергу Нобелевскую премию. АЛ ДШ
1 Кстати, точно такая же история случилась в 1946 и 1976 годах. Поневоле начнешь верить в нумерологию. Обратно к тексту
2 В Нобелевской летописи не столь уж редкий. С 1901 года было зафиксировано шесть «дуплетов» отец-сын. Обратно к тексту
Антисиняя сила
Медицина, химия
Премия по физиологии и медицине 2004 года тоже присуждена американцам: 58-летнему Ричарду Акселю (Richard Axel, Университет Колумбии) и 57-летней Линде Бак (Linda Buck, Институт изучения рака им. Ф. Хатчинсона в Сиэтле). Работа лауреатов, посвященная изучению обонятельных рецепторов и организации системы органов обоняния, была опубликована в 1991 году.
«Химическая» награда досталась израильско-американской команде — Аарону Цихановеру (Aaron Ciechanover, 57 лет) и Аврааму Гершко (Avram Hershko, 67 лет) из института «Технион» в Хайфе (фото 4), а также 78-летнему патриарху Ирвину Роузу (Irwin Rose, фото 5) из Калифорнийского университета в Ирвине. Их исследования, опубликованные в 80-х годах, посвящены механизму уничтожения ненужных белков в клетках.


Любопытно, что обе премии присуждены за работы, исследующие молекулярные механизмы, которые лежат в основе биологических процессов. После эйфории от того, что мы узнали, из каких молекул построена жизнь, наступило отрезвление, вызванное головокружительной сложностью функционирования биологических систем. Поэтому изыскания, раскрывающие механизм работы той или иной молекулярной «машинки», следует оценивать по достоинству. Хотя… ощущения научной революции достижения нынешних нобелевских лауреатов не оставляют. Это добротные исследования, выполненные в рамках общей научной парадигмы.
Чем же примечательны отмеченные работы?
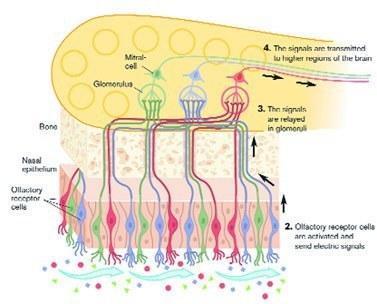
Аксель и Бак (фото 6) изучали самый сложный из наших органов чувств. Ученые экспериментировали на мышах, но их выводы вполне применимы и к человеку. Благодаря компактной химической лаборатории в дыхательных путях (рис. 7) мы способны различать около десяти тысяч типов пахучих молекул. Тысяча генов (примерно 3% от общего количества) человека отвечает за функционирование органа обоняния. Под их управлением развивается система, состоящая из аналогичного числа разновидностей клеток-рецепторов. В каждом типе рецепторов синтезируются белки, позволяющие реагировать на определенное количество молекул. Мозг анализирует, какие рецепторы среагировали на то или иное вещество, и формирует уникальный образ запаха.

Для сравнения можно указать, что зрение, благодаря которому человек получает львиную долю информации, связано с работой всего лишь четырех типов рецепторов (трех чувствительных к свету с определенной длиной волны и еще одного, реагирующего на весь видимый спектр). Сложность обоняния, кстати, — одна из причин, не позволяющих виртуальной реальности толком «обрести аромат». Это чувство, как отметил Нобелевский комитет, оказывает сильное влияние на эмоциональную жизнь.
Одно из возможных применений работы Цихановера, Гершко и Роуза — создание искусственных биосенсоров, копирующих работу обонятельного рецептора.
Нынешняя премия по химии тесно связана с биологией. Человеческая клетка содержит около 100 тысяч различных белков. Основное внимание обычно уделяется их синтезу (с этой темой связано не менее пяти Нобелевских премий), но не менее интересно и их разрушение. Удивительно, что хотя усвоение пищевых белков идет с высвобождением энергии, утилизация собственных белков требует ее расхода. Лауреатам удалось показать, что в процессе утилизации с обреченным белком связывается «черная метка» — состоящий из 76 аминокислот полипептид убиквитин.
Маркированный белок доставляется в протеосому — специализированную органеллу, где он расщепляется на аминокислоты. Последние могут использоваться как строительные блоки при производстве новых белков. Понимание описанного механизма может быть полезно для лечения ряда заболеваний, позволяя сократить или повысить содержание того или иного белка в клетке.
Отметим, что немалая часть работы была выполнена по субботам, которые Гершко и Цихановер проводили у Роуза в Филадельфии. Через двадцать с лишним лет нарушение запрета на работу в Шабат принесло ученым самую авторитетную премию в мире науки.
Интересно, а когда будут награждаться исследования, выполненные в 2004 году?
Д. Шабанов. Нобель троицу любит // Компьютерра, М., 2008. – № 39 (755)
Д. Шабанов. Большая польза большой науки. Медицина // Компьютерра, М., 2007. – № 38 (706).
А. Левин, Д. Шабанов. Естественно, Америка // Компьютерра, М., 2006. – № 37 (657)
Д. Шабанов. Антисиняя сила. Медицина, химия // Компьютерра, М., 2004. – № 38 (562)