Цитогенетические особенности эритроцитов зеленых лягушек из Северско-Донецкого центра разнообразия Pelophylax esculentus complex
А.А.Бондарева, Ю.С.Бибик, С.М.Самило, Д.А.Шабанов
Харьковский национальный университет имени В.Н.Каразина
d.a.shabanov@gmail.com
Рассматривается влияние триплоидности на морфологические параметры эритроцитов у Pelophylax esculentus, гемиклональных гибридов зеленых лягушек. Показано, что триплоидность приводит к увеличению размеров эритроцитов, ядерно-цитоплазматическое отношение остается постоянным, относительная поверхность клетки уменьшается. Эритроциты триплоидов характеризуются более эллиптической формой, чем эритроциты диплоидов. В зависимости от размеров эритроцитов изученные представители Pelophylax esculentus разделены на три группы: особи с аномально мелкими эритроцитами, типичные диплоиды и триплоиды. Определено количество гранул гетерохроматина в ядрах эритроцитов лягушек, относящихся к этим трем группам. Вероятно, у особей с аномально мелкими эритроцитами ядра клеток содержат относительно большее количество гетерохроматина.
Ключевые слова: Pelophylax esculentus (= Rana esculenta), эритроциты, триплоиды, диплоиды, гетерохроматин.
Цитогенетичні особливості еритроцитів зелених жаб з Сіверсько-Донецького центру різноманіття Pelophylax esculentus complex
А.А.Бондарева, Ю.С.Бибик, С.М.Самило, Д.А.Шабанов
Розглядається вплив триплоїдності на морфологічні параметри еритроцитів у Pelophylax esculentus, геміклональних гібридів зелених жаб. Показано, що триплоїдність призводить до збільшення розмірів еритроцитів, ядерно-цитоплазматичне відношення залишається постійним, відносна поверхня клітини зменшується. Еритроцити триплоїдів характеризуються більш еліптичною формою, ніж еритроцити диплоїдів. В залежності від розмірів еритроцитів досліджені представники Pelophylax esculentus поділені на три групи: особини з аномально дрібними еритроцитами, типові диплоїди та триплоїди. Визначено кількість гранул гетехроматину у ядрах еритроцитів жаб, що відносяться до цих трьох груп. Вірогідно, у особин з аномально дрібними еритроцитами ядра клітин містять відносно більшу кількість гетерохроматину.
Ключові слова: Pelophylax esculentus (= Rana esculenta), еритроцити, триплоїди, диплоїди, гетерохроматин.
Erythrocytes cytogenetic characteristics of green frogs from Siversky Donets centre of Pelophylax esculentus complex diversity
A.A.Bondarieva, Yu.S.Bibik, S.M.Samilo, D.A.Shabanov
The influence of triploidy on erythrocyte morphological parameters of Pelophylax esculentus, hemiclonal hybrids of green frogs, is considered. It is shown that triploidy leads to enlarging of erythrocytes while nuclear-cytoplasmic ratio remains constant and relative cell surface decreases. Triploid erythrocytes are characterized by more ellipsoid shape in comparison with diploid cells. Due to erythrocyte size investigated Pelophylax esculentus were divided into three groups: individuals with abnormally small erythrocytes, typical diploids and triploids. The heterochromatin granules quantity in frogs erythrocyte nuclei was estimated. It is supposed that erythrocyte nuclei of individuals with abnormally small cells contain relatively more heterochromatin.
Key words: Pelophylax esculentus (= Rana esculenta), erythrocytes, triploids, diploids, heterochromatin.
Введение
В состав гибридогенного комплекса зеленых лягушек (Pelophylax esculentus complex) входят два родительских вида: прудовые лягушки, Pelophylax lessonae (Camerano, 1882) и озерные лягушки Pelophylax ridibundus (Pallas, 1771), а также их гибриды (получившие название, аналогичное видовому): съедобные лягушки, Pelophylax esculentus (Linnaeus, 1758). Pelophylax esculentus демонстрируют необычные способы воспроизводства, использующие, в частности, гемиклональное наследование – клональную передачу в гаметы одного из родительских геномов. В Северско-Донецком центре разнообразия зеленых лягушек (Шабанов, Литвинчук, 2010) широко распространены как диплоидные, так и триплоидные P. esculentus. Среди них есть и особи, имеющие два генома P. ridibundus и один – P. lessonae, и особи с двумя геномами P. lessonae и одним P. ridibundus.
Диплоидные и триплоидные P. esculentus обитают в одних местообитаниях, размножаются в общих нерестовых группах, имеют сходные размеры, существенно не отличаются по продолжительности жизни и не имеют отчетливых внешних различий или поведенческих особенностей (Plotner, 2005; Шабанов, Литвинчук, 2010; Усова, 2010). Это делает их замечательным объектом для изучения влияния плоидности клеток на разнообразные цитологические параметры.
Современной батрахологии известен ряд групп амфибий, в состав которых входят близкородственные ди-, три- и тетраплоидные виды, как это, например, наблюдается в группе зеленых жаб, Bufo viridis complex (Litvinchuk et al., 2011). Однако в случае таких групп особи с разной плоидностью принадлежат к разным видам, отличающимся по особенностям своих местообитаний и прошедших через более или менее независимую эволюцию. Геномы триплоидных зеленых жаб эволюционировали в триплоидных организмах, а геномы триплоидных зеленых лягушек получены ими от диплоидных родительских видов. Можно ожидать, что цитологические эффекты, вызванные триплоидностью, будут проявляться у P. esculentus более явно, не будучи скомпенсированными действием естественного отбора. Наблюдаемые свойства организмов, в том числе характеристики их клеток, являются результатом компромисса между потребностями оптимизации различных параметров (Бигон и др., 1989; Расницын, 2002). У триплоидных лягушек геномы, являющиеся результатом эволюции диплоидных организмов, оказываются в триплоидных ядрах. Интересной задачей для изучения является выяснение того, как это повлияет на ядерно-цитоплазматическое отношение, относительную поверхность клеток, их количество в отдельных органах и в организме в целом, другие параметры клеток и организмов.
Ди- и триплоиды P. esculentus практически неотличимы на биохимическом уровне, поскольку развиваются под управлением одинаковых геномов, полученных от родительских видов. Весьма похожи они и на организменном уровне (Plotner, 2005; Усова, 2010). Однако они резко отличаются на клеточном уровне, что является следствием разного количества родительских геномов, приходящихся на каждую клетку. Это связано, в первую очередь, с тем, что для сохранения постоянства ядерно-цитоплазматического отношения у триплоидов, ядро которых в 1,5 раза больше по сравнению с диплоидами, вслед за ядром должно увеличиваться и содержание цитоплазмы, а, следовательно, и размер клетки (Plotner, 2005; Шабанов, Литвинчук, 2010).
Для диплоидных и триплоидных лягушек зафиксировано значимое различие в размерах эритроцитов, и это используют как один из способов определения плоидности лягушек (George, Lennartz, 1980; Polls Pelaz, Graf, 1988; Plotner, 2005). Подробное изучение влияния плоидности лягушек на другие гематологические показатели не проводилось, в то время как для некоторых видов рыб показано, что триплоидность в разной степени влияет на различные морфологические параметры эритроцитов. Так, большая ось клетки у изученных рыб увеличивается в большей степени по сравнению с малой осью (Cal et al., 2005). При увеличении размеров клеток следует ожидать уменьшения их относительной поверхности (объем клеток растет пропорционально третьей степени линейных размеров, а площадь поверхности – медленнее, пропорционально второй степени). Это означает, что транспорт веществ через поверхность эритроцитов у триплоидных особей может быть затруднен. Как это обстоятельство повлияет на газообмен, неизвестно.
В нашей работе предпринято сравнение эритроцитов ди- и триплоидных гибридов зеленых лягушек (Pelophylax esculentus). Первым уровнем сравнения эритроцитов стало изучение их размеров и морфологии, а вторым – сравнение степени конденсированности ядерного материала.
Материалы и методы
Мы исследовали выборку лягушек, собранных в бассейне р. Северский Донец в Змиевском районе Харьковской области 18 сентября 2010 года. Выборка из 58 особей, определенных по внешним признакам (Шабанов и др., 2006) как P. esculentus (длина тела 6,91±0,62 см), была представлена преимущественно самцами (54 особи).
Для каждой особи делали мазок крови по стандартной методике, который без окрашивания фотографировали под большим увеличением микроскопа (?40) с помощью USB-камеры. Под тем же увеличением фотографировали объект-микрометр. С помощью программы PDF-XChange Viewer по фотографиям мазков для 10 клеток на каждый мазок производили измерение большой и малой осей эритроцита, а также большой и малой осей его ядра; затем эти измерения переводили в микрометры. Площадь сечения клетки (видимого на препарате) рассчитывали по формуле  , площадь поверхности клетки – как площадь поверхности эллипса вращения
, площадь поверхности клетки – как площадь поверхности эллипса вращения 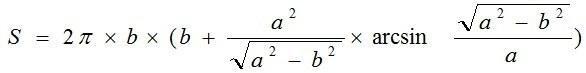 , объем по формуле
, объем по формуле 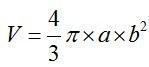 , где а и b – большая и малая полуоси эритроцита соответственно. Аналогично высчитывали площадь сечения, площадь поверхности и объем ядра. На основании полученных данных подсчитали ядерно-цитоплазматическое отношение.
, где а и b – большая и малая полуоси эритроцита соответственно. Аналогично высчитывали площадь сечения, площадь поверхности и объем ядра. На основании полученных данных подсчитали ядерно-цитоплазматическое отношение.
Для 14 особей из данной выборки плоидность, а также принадлежность к Pelophylax esculentus была точно установлена точно С.Н.Литвинчуком и Ю.М.Розановым (Цитологический институт РАН, г. Санкт-Петербург) в результате измерения количества ДНК, приходящегося на клетку, при помощи проточной ДНК-цитометрии (метод охарактеризован, например, в Litvinchuk et al., 2011).
Для сравнения степени конденсации гетерохроматина в эритроцитах готовые препараты мазков крови окрашивали по методу Фёльгена (окраска реактивом Шиффа с предварительным холодным гидролизом 5N HCl в течение 20 мин) (Роскин, Левинсон, 1957). Количество гранул гетерохроматина подсчитывали под большим увеличением микроскопа (?640). Всего было проанализировано 11 мазков крови (по 50 клеток на мазок), из них 6 диплоидных, 3 триплоидных и 2 – особей с аномально мелкими эритроцитами (см. далее).
Для определения степени деконденсации гетерохроматина в ядрах эритроцитов использовали различное время кислотного гидролиза. Для данного исследования две части одного мазка эритроцитов определенной особи подвергали окраске по методу Фёльгена с разным временем экспозиции в соляной кислоте (20 мин и 60 мин). Оптическую плотность ядер и цитоплазмы эритроцитов определяли по фотографиям окрашенных мазков с помощью программы Adobe Photoshop. Изучили степень деконденсации хроматина ядер эритроцитов 10 особей лягушек: 5 диплоидов и 5 триплоидов. Отношение оптической плотности ядра к оптической плотности цитоплазмы рассчитывали по формуле: 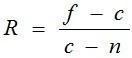 , где f – оптическая плотность фона; c – оптическая плотность цитоплазмы; n – оптическая плотность ядра.
, где f – оптическая плотность фона; c – оптическая плотность цитоплазмы; n – оптическая плотность ядра.
Значимость отличий параметров эритроцитов ди- и триплоидов P. esculentus (а также диплоидов и особей с аномально мелкими эритроцитами) оценивали с помощью непараметрического критерия Манна-Уитни.
Результаты и обсуждение
По средней площади сечения эритроцитов для каждой особи были выделены три группы лягушек (рис. 1). 43 особи группы ІІ имели типичные для диплоидов эритроциты, длиной 21–26 мкм, 12 особей группы ІІІ имели крупные эритроциты (больше 26 мкм), характерные для триплоидов. При этом в группе триплоидов выделяются две подгруппы: особи с эритроцитами до 39 мкм в длину и особи, эритроциты которых более 40 мкм. Три особи из группы І имели аномально мелкие, размерами меньше 20 мкм, эритроциты (табл. 1).
Из изученных с помощью проточной ДНК-цитометрии особей все 12 представителей группы ІІ (в том числе особи с самыми крупными эритроцитами в группе, длиной 26,1 мкм, и с одними из самых мелких, 22,6 мкм), оказались диплоидами. Из группы І была изучена одна особь с самыми мелкими эритроцитами (17,8 мкм), которая была определена как диплоид. Для особи из группы ІІІ с эритроцитами длиной 27,3 мкм подтвердили предположение о том, что она является триплоидом RRL (т.е. с двумя геномами P. ridibundus и одним геномом P. lessonae), причем с наименьшими для группы триплоидов эритроцитами.
Сравнение морфологических параметров типичных ди- и триплоидных клеток (группы ІІ и ІІІ) показало, что триплоидность приводит к значимому (p<0,001) увеличению почти всех параметров клетки (табл. 1), за исключением двух: происходит незначимое уменьшение ядерно-цитоплазматического отношения (p=0,16) и значимое уменьшение относительной поверхности клетки на 10,6% (p<0,001). Увеличение происходит в различной степени для разных показателей. Так, увеличение большой оси клетки и ядра происходит на 22,9 и 18,6% соответственно, а малых осей – на 9,7 и 9,4%. Это приводит к тому, что триплоидная клетка приобретает более эллиптическую форму. Изменение формы эритроцита, возможно, связано с адаптацией более крупных эритроцитов к сравнительно узким кровеносным сосудам (Fankhauser, 1941). Увеличение же большинства морфологических параметров эритроцитов у триплоидов должно приводить к изменению интегральной интенсивности газообмена.
Табл. 1.
Сравнение морфологических параметров аномально мелких, диплоидных и триплоидных эритроцитов Pelophylax esculentus (указано среднее значение и его 95% доверительный интервал)
|
Параметр |
Диплоиды (D) |
Триплоиды (T) |
T/D |
Особи с аномально мелкими эритроцитами (Р) (n=3) |
D/Р |
|
Большая ось клетки (мкм) |
23,96 |
29,45 |
1,229*** |
18,44 |
1,30** |
|
Малая ось клетки (мкм) |
14,99 |
16,48 |
1,097*** |
11,43 |
1,31** |
|
Площадь сечения клетки (мкм2) |
282,47 |
381,68 |
1,351*** |
165,6 |
1,71** |
|
Объем клетки (мкм3) |
2841,5 |
4228,0 |
1,488*** |
1265,3 |
2,25** |
|
Большая ось ядра (мкм) |
9,67 |
11,47 |
1,186*** |
7,97 |
1,21** |
|
Малая ось ядра (мкм) |
5,65 |
6,18 |
1,094*** |
4,67 |
1,21** |
|
Площадь сечения |
43,13 |
55,75 |
1,293*** |
29,47 |
1,47** |
|
Объем ядра (мкм3) |
165,73 |
232,98 |
1,406*** |
93,74 |
1,77** |
|
Ядерно-цитоплазматическое отношение |
0,061 |
0,056 |
0,918 |
0,075 |
0,81* |
|
Относительная поверхность клетки |
0,66 |
0,60 |
0,894*** |
0,86 |
0,77** |
Неожиданным результатом является существенная разница между группами особей І и ІІ. Объем мелких клеток и их ядер отличается от клеток «типичных» диплоидов на такую же величину, на которую последние отличаются от триплоидов (рис. 2). Именно такими размерами должны были бы характеризоваться гипотетические гаплоидные эритроциты лягушек. Лягушки группы І имеют эритроциты меньше 20 мкм в длину, в то время как в литературе (Plotner, 2005) указывается, что нормальные эритроциты диплоидных лягушек имеют размеры в пределах 20–26 мкм.
Сравнение особей с аномально мелкими эритроцитами и «типичных» диплоидов по тем же параметрам, что и сравнение диплоидов с триплоидами, показало, что все параметры эритроцитов группы І значимо меньше диплоидных в среднем на 30%, а их ядер – на 21%. Ядерно-цитоплазматическое отношение несколько увеличивается у аномально мелких эритроцитов; это же касается и относительной поверхности клетки, которая увеличивается на 30%. Это должно влиять на интенсивность газообмена, диффузии кислорода сквозь мембрану эритроцита и, как следствие, кислородную емкость крови. Кроме того, уменьшение размеров эритроцитов может позволять увеличивать их количество в кровотоке.

Рис. 1. Распределение особей Pelophylax esculentus по средней площади сечения их эритроцитов
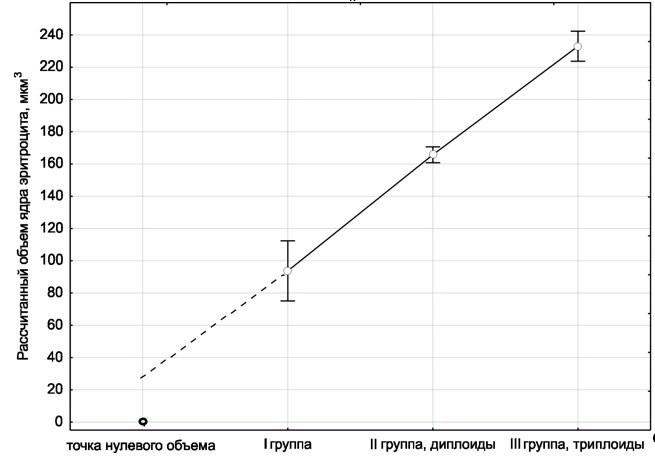
Рис. 2. Сравнение групп Pelophylax esculentus по объему эритроцитов (по результатам дисперсионного анализа, вертикальные линии демонстрируют доверительные интервалы)
Одна из особей, относящихся к группе І, была исследована методом проточной ДНК-цитометрии С.Н.Литвинчуком и Ю.М.Розановым. По их данным, в крови этой особи зарегистрированы только диплоидные клетки.
Для объяснения небольших размеров эритроцитов у P. esculentus из группы І мы выдвинули две альтернативных гипотезы:
(1) у таких лягушек происходит гаплоидизация как минимум некоторых соматических клеток, связанная с элиминацией одного из геномов, которая может быть аналогом премейотической элиминации в клетках зародышевой линии, обеспечивающей гемиклональное наследование у P. esculentus;
(2) в организме таких лягушек происходит функциональная гаплоидизация клеток, связанная с гиперконденсацией одного из геномов, вызывающей уменьшение ядра и, соответственно, клетки в целом.
Очевидно, что результат проточной ДНК-цитометрии является сильным аргументом против первого предположения. Тем не менее, желательно было подтвердить этот результат иными методами.
К сожалению, поиски особей с аномально мелкими эритроцитами, предпринятые нами на протяжении полевых сезонов 2011 и 2012 годов, не увенчались успехом. Поэтому для проверки второй из предложенных гипотез мы решили сравнить степень конденсации хроматина в диплоидных, триплоидных и аномально мелких эритроцитах. Реактив Шиффа окрашивает ДНК ядра, при этом участки гетерохроматина имеют более интенсивную окраску, чем участки эухроматина. Зачастую гетерохроматин виден в ядрах в виде гранул, и по количеству таких гранул можно косвенно судить о степени конденсации ДНК в ядре (Shckorbatov, 1999). Количество гранул гетерохроматина на ядро составляло в среднем 16 для диплоидов, 27 для триплоидов и 22 для особей с аномально мелкими эритроцитами (рис. 3). Таким образом, ядра эритроцитов триплоидов содержат более чем в полтора раза большее количество гранул гетерохроматина, чем ядра эритроцитов диплоидов. Это может говорить о примерно одинаковой степени конденсации хроматина у особей из этих групп.
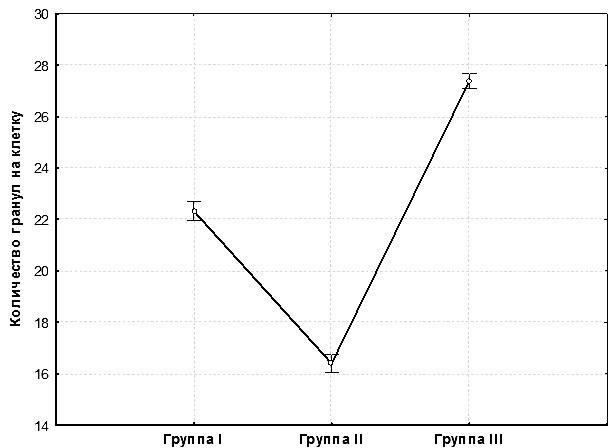
Рис. 3. Сравнение групп Pelophylax esculentus по количеству гранул гетерохроматина в ядрах эритроцитов (по результатам дисперсионного анализа; вертикальные линии демонстрируют доверительные интервалы)
Две особи из группы І, у которых удалось подсчитать количество гранул гетерохроматина, имеют большее их количество, чем особи из группы ІІ (типичные диплоиды), но меньшее, чем триплоиды. Такой результат можно рассматривать как подтверждение справедливости второй из выдвинутых нами гипотез, объясняющих мелкий размер эритроцитов у лягушек из группы І. Причины такой функциональной гаплоидизации остаются непонятными. Следует заметить, что такие клетки, имея большую по сравнению с ди- и триплоидными эритроцитами относительную площадь поверхности и меньший размер, могут обеспечивать более эффективный газообмен в кровотоке, что должно повышать жизнеспособность организма в условиях недостатка кислорода.
Из трех особей с аномально мелкими эритроцитами одна имела в крови значительное количество нетипичных клеток (рис. 4). При окрашивании по Фёльгену они напоминают либо безъядерные клетки с яркой цитоплазмой, либо безцитоплазменные клетки. Хотя природа этих клеток остается для нас неизвестной, их наличие свидетельствует о необычном, вероятно болезненном, состоянии данной особи. Подсчет гранул в ядрах эритроцитов на препарате крови этой особи оказался невозможным.
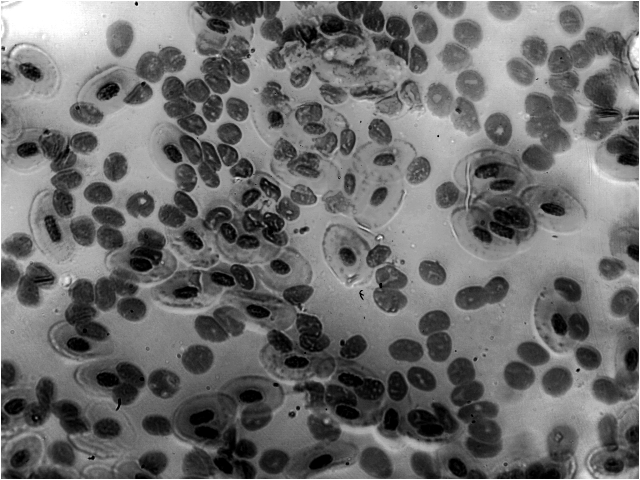
Рис. 4. Нетипичные клетки на препарате мазка крови Pelophylax esculentus с аномально мелкими эритроцитами (?640)
По данным дисперсионного анализа различия между степенью деконденсации хроматина в диплоидных и триплоидных ядрах значимы (p=0,0036). При этом диплоидные ядра при длительном гидролизе изменяют отношение оптической плотности с 3 до 4, а триплоиды с 2,5 до 4,5. Это говорит о том, что ядра триплоидов содержат больше ядерного материала, чем ядра диплоидов и деконденсация у них происходит более резко. Кроме того, как было сказано выше, геном триплоидных особей более конденсирован, чем геном диплоидов.
Выводы
В зависимости от размеров эритроцитов изученные представители Pelophylax esculentus разделены на три группы: особи с аномально мелкими эритроцитами, типичные диплоиды и триплоиды. Данные ДНК-цитометрии подтверждают определение ди- и триплоидов по параметрам эритроцитов. Показано, что триплоидность приводит к увеличению морфологических параметров эритроцитов, ядерно-цитоплазматическое отношение остается постоянным, относительная поверхность клетки уменьшается. Частично уменьшение относительной поверхности клеток компенсируется более эллиптической формой эритроцитов триплоидов. Количество гранул гетерохроматина ядер эритроцитов значимо отличается в трех выделенных группах. Поскольку особи с аномально мелкими эритроцитами имеют больше гетерохроматина, чем типичные диплоиды, можно заключить, что в эту группу попадают диплоидные особи с повышенным уровнем гетерохроматинизации ДНК. По-видимому, соотношение между эу- и гетерохроматином в ядрах эритроцитов является важной характеристикой ди- и триплоидных особей: ДНК триплоидных клеток является более конденсированной, чем у диплоидов. Более высокая степень компактизации хроматина в ядрах эритроцитов триплоидов при сохранении постоянного ядерно-цитоплазматического отношения и при уменьшении относительной поверхности клеток свидетельствуют в пользу более низкой интенсивности метаболизма в клетках триплоидов.
Благодарности
Авторы выражают искреннюю благодарность С.Н.Литвинчуку и Ю.М.Розанову (г.Санкт-Петербург) за неоценимую помощь в идентификации изученных особей, Ю.Г.Шкорбатову и В.Н.Пасюге за помощь в освоении методики окраски препаратов, а также всем студентам и сотрудникам биологического факультета ХНУ имени В.Н.Каразина, помогавшим в сборе и обработке материала.
Список литературы
Бигон М., Харпер Дж., Таунсенд К. Экология. Особи, популяции и сообщества: в 2-х т. Т.2. – М.: Мир, 1989. – 477с. /Bigon M., Kharper Dzh., Taunsend K. Ekologiya. Osobi, populyatsii i soobshchestva: v 2-kh t. T.2. – M.: Mir, 1989. – 477s./
Расницын А.П. Процесс эволюции и методология систематики // Тр. Рус. энтомол. о-ва. – 2002. – Т.73. – С. 1–108. /Rasnitsyn A.P. Protsess evolyutsii i metodologiya sistematiki // Tr. Rus. entomol. o-va. – 2002. – T.73. – S. 1–108./
Роскин Г.И., Левинсон Л. Микроскопическая техника. – М.: Советская наука, 1957. – 469с. /Roskin G.I., Levinson L. Mikroskopicheskaya tekhnika. – M.: Sovetskaja nauka, 1957. – 469s./
Усова Е.Е. Возрастная структура представителей гибридогенного комплекса зеленых лягушек в Харьковской области // Видовые популяции и сообщества в антропогенно трансформированных ландшафтах: состояние и методы его диагностики. Мат. XI Междунар. научно-практич. экологич. конф. – Белгород, 2010. – С.131. /Usova Ye.Ye. Vozrastnaya struktura predstaviteley gibridogennogo kompleksa zelenykh lyagushek v Khar'kovskoy oblasti // Vidovyye populyatsii i soobshchestva v antropogenno transformirovannykh landshaftakh: sostoyaniye i metody yego diagnostiki. Mat. XI Mezhdunar. nauchno-praktich. ekologich. konf. – Belgorod, 2010. – S.131./
Шабанов Д.А., Зиненко А.И., Коршунов А.В. и др. Изучение популяционных систем зеленых лягушек (Rana esculenta complex) в Харьковской области: история, современное состояние и перспективы // Вісник Харківського національного університету імені В.Н.Каразіна. Серія: біологія. – 2006. – Вып.3, №729. – С. 208–220. /Shabanov D.A., Zinenko A.I., Korshunov A.V. i dr. Izucheniye populyatsionnykh sistem zelenykh lyagushek (Rana esculenta complex) v Khar'kovskoy oblasti: istoriya, sovremennoye sostoyaniye i perspektivy // Vіsnyk Kharkіvs'kogo natsіonal'nogo unіversytetu іmenі V.N.Karazіna. Serіya: bіologіya. – 2006. – Vyp.3, №.729. – S. 208–220./
Шабанов Д.А., Литвинчук С.Н. Зеленые лягушки: жизнь без правил или особый способ эволюции? // Природа. – 2010. – №3 (1135). – С. 29–36. /Shabanov D.A., Litvinchuk S.N. Zelenyye lyagushki: zhizn' bez pravil ili osobyy sposob evolyutsii? // Priroda. – 2010. – №3 (1135). – S. 29–36./
Cal R.V., Vidal S., Camacho T. et al. Effect of triploidy on turbot haematology // Comparative Biochemistry and Physiology. – 2005. – Vol.141 (1). – P. 35–41.
Fankhauser G. Cell size, organ and body size in triploid newts (Triturus viridescens) // Journal of Morphology. – 1941. – Vol.68, Issue 1. – P. 161–177.
George S.A., Lennartz M.R. Methods for determining ploidy in amphibians: nucleolar number and erythrocyte size // Experientia. – 1980. – Vol.36. – P. 687–688.
Litvinchuk S.N., Mazepa G.O., Pasynkova R.A. et al. In?uence of environmental conditions on the distribution of Central Asian green toads with three ploidy levels // Journal of Zoological Systematics and Evolutionary Research. – 2011. – Vol.49, Issue 3. – P. 233–239.
Plotner J. Die westpalaarktichen Wasserfrosche. – Bielefeld: Laurenti-Verlag, 2005. – 161s.
Polls Pelaz M., Graf J.-D. Erythrocyte size as an indicator of ploidy level in Rana kl. esculenta before and after metamorphosis // Alytes. – 1988. – Vol.7. – P. 53–61.
Shckorbatov Y.G. He-Ne laser light induced changes in the state of chromatin in human cells // Naturwissenschaften, 1999. – Vol.86, №9. – P. 452–453.
________________________________________
Представлено: С.Н.Литвинчук / Presented by: S.N.Litvinchuk
Рецензент: А.В.Некрасова / Reviewer: A.V.Nekrasova
Подано до редакції / Received: 19.03.2012