Неофициальный рабочий перевод статьи, представляющей значительный интерес.
Русский перевод названия Bufo baturae - пуштунская жаба - используется по совету С.Н. Литвинчука и носит предварительный характер.
Одновременная менделевская и клональная передача геномов у размножающихся половым путем полностью триплоидных позвоночных
Мейоз у триплоидных особей, казалось бы, сталкивается с непреодолимыми трудностями при делении нечетного числа хромосомных наборов на два. Триплоидные позвоночные обычно обходят эту проблему с помощью либо асексуальности или некоторых форм гибридогенеза, в том числе мейотического гибридогенеза, который включает репродуктивное сообщество различной плоидности и с разными наборами геномов. Пуштунские жабы (Bufo baturae; 3n = 33 хромосом), однако, представляют полностью триплоидное половое размножение. Этот гибридный вид имеет две копии генома, содержащего ядрышковый организатор (NOR +) на хромосоме 6, а третий геном без него (NOR—). Самцы производят только гаплоидную NOR+ сперму, в то время как яйцеклетки диплоидны и содержат один NOR+ и один NOR— хромосомный набор. Здесь мы проводим родственный анализ по кодоминантным маркерам микросателлитов (1) для подтверждения чисто клональной и материнской передачи NOR— набора, и (2), чтобы продемонстрировать менделевскую сегрегацию и рекомбинацию NOR+ наборов у обоих полов. Это новый способ размножения у позвоночных («предварительно выравнивающего гибридного мейоза») предлагает идеальную возможность для изучения эволюции нерекомбинантных геномов. Выяснение механизмов, которые позволяют одновременную передачу двух геномов, одного менделевского, другого клонального, может пролить свет на общие процессы, которые регулируют мейоз у позвоночных.
1. Введение
По второму закону Менделя [1], аллели различных генов рекомбинируют независимо друг от друга во время гаметобразования. У размножающихся половым путем видов случайная передача отцовского и материнского геномов достигается за счет независимой сегрегации хромосом во время мейоза. Некоторые геномы животных, однако, демонстрируют отклонения передачи, часто в зависимости от того, от какого родителя они происходят, и, как правило, вследствие древней гибридизации [2]. Гибридные линии муравьев, например, несут два независимо развивающихся генома, которые передаются либо мейотически [3] либо клонально [4,5]. Аналогичные процессы происходят у гибридогенетических позвоночных: при диплоидном гибридогенезе один геном передается клонально через гибридные линии, а другой — половым путем от одного из родительских видов [6]. При мейтическом гибридогенезе оба гибридизирующихся генома могут передаваться половым путем, через скрещивания диплоидных и триплоидных гибридов с различными наборами геномов (рис. 1, [14,16]).
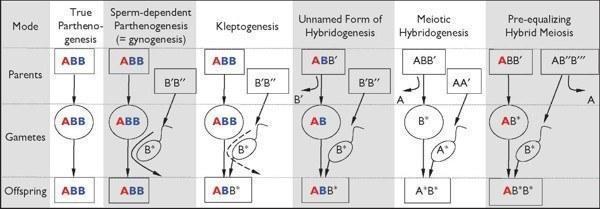
Рисунок 1. Способы размножения триплоидных позвоночных. Показаны геномы родителей, гамет и потомства (строки) при различных способах репродукции (столбцы). A, В: геномы различных родительских видов. Полужирные окрашенные символы указывают клонально передающиеся копии, в то время как обычные черные символы с индексами обозначают различающиеся (рекомбинантные) копии.
Истинный партеногенез: клональный (самцы отсутствует), исключительно у рептилий [7,8];
Спермозависимый партеногенез (т.е. гиногенез): клональный, эмбриогенез требует запуска аллоспецифичными сперматозоидами, которые не включаются (при редком "отцовском просачивании» может передаваться субгеномное количество отцовской ДНК), происходит у костистых рыб и хвостатых амфибий [9];
Клептогенез: самки получают, полностью или частично, геномы от своих партнеров по не до конца понятным механизмам, что позволяет им очищать геном от вредных аллелей (здесь BB), описан у хвостатых амфибий [10];
Неназванная форма гибридогенеза: клональные диплоидные яйцеклетки оплодотворяются спермой рекомбинирующих видов с половым размножением, которые могут быть диплоидными или триплоидными (как при мейотическом гибридогенезе), встречается у бесхвостых амфибий и костистых рыб [11-13];
Мейотический гибридогенез: может происходить у триплоидных самцов и/или самок; найден у костистых рыб и бесхвостых амфибий [14,15]; повышение плоидности диплоидного потомства, которое может производить гибридные диплоидные гаметы, может происходить в следующем поколении (становятся затем, например, ABB') для того чтобы восстановить триплоидию (по аналогии с предшествующей формой гибридогенеза);
Предварительно выравненный гибридный мейоз: происходит у пуштунской жабы: оба пола триплоидные и демонстрируют менделевскую сегрегацию и рекомбинацию в геномах B (эквивалент NOR+ настоящей статьи), в то время как A геном (т.е. NOR— ) клонально передается от матери.
Двуполому воспроизводству чистых триплоидов препятствует проблема равного распределения трех наборов хромосом в мейозе [17], см. обзор [18]. Гибриды Poeciliopis, например, являются гибридогенетическими в своих диплоидных формах, но становятся гиногенетическими как триплоиды [19,20]. В альтернативе гиногенеза или партеногенеза (рис. 1, [7-9,21]) некоторые триплоидные позвоночные объединяют клональные и половые элементы в их способе воспроизводства, например, клептогенезе или различных формах гибридогенеза [10,22-24], в том числе мейотического гибридогенеза, который требует репродуктивного сообщества разного уровня плоидности и состава геномов.
В этом контексте пуштунские жабы (Bufo baturae) особенные, т.к являются триплоидами, размножающимися половым путем [25]. Этот вид гибридного происхождения обитает в высоких горах на севере Пакистана (более 1500 м над уровнем моря). Его геном (3n = 33; [25,26]) состоит из двух наборов хромосом несущих ядрышковый организатор (NOR+) на хромосоме 6, и другой набор без такого региона (NOR— ; рисунок 2). Самцы производят только гаплоидную NOR+ сперму, предположительно, устраняя NOR— набор (11 хромосом) до начала мейоза. В отличие от этого, яйцеклетки диплоидны (2n = 22) с одним NOR+ и один NOR— набором. В незрелых ооцитах обнаруживают 22 бивалента хромосом типа ламповых щеток [25].
Таким образом, было сделано предположение, что NOR— набор передается чисто по материнской линии и клонально. Тем не менее, остается неизвестным, рекомбинирует ли NOR+ набор и как это происходит. Для самок можно выдвинуть две гипотезы (рис. 2): (а) Один NOR+ набор элиминируется (либо случайно либо в зависимости от происхождения родителей), после чего в ходе эндомитоза автодуплицируются два оставшихся набора. Мейоз в таком случае происходит между псевдобивалентами [27], и производит один или максимум два класса в случае клональных диплоидных яйцеклеток. Альтернатива состоит в том (б), что NOR— набор автодуплицируются до мейоза, во время которого два NOR+ набора нормально рекомбинируют.
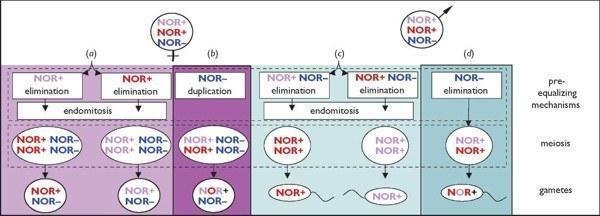
Рисунок 2. Схема репродуктивной системы у триплоидных пуштунских жаб с гипотетическими механизмами (а) и (б) оогенеза и (с) и (d) сперматогенеза. Синий NOR— символ: нерекомбинантный (клональный) хромосомный набор без ядрышковых организаторов. Красный или пурпурный NOR+ символы: различные NOR-несущие наборы хромосом. Смешанные красный и пурпурный NOR+ символы: рекомбинировавшие NOR-несущие наборы. Механизмы, подтвержденные в данном исследовании, заключены в рамку.
Для самцов, аналогично, первая гипотеза (рис. 2, c) заключается в том, что весь материнский вклад (NOR+, NOR— ) исключается, а затем отцовской NOR+ дублируется вследствие премейотического эндомитоза. Мейотические пары (NOR+/NOR+; [25]), таким образом, представляют собой псевдобиваленты, подразумевая клональную передачу одного набора NOR+. Сперматоциты будут состоять из одного полилокусного генотипа (или как максимум двух, если элиминация NOR+ происходила случайным образом). Альтернатива (рис. 2, d) - устранение только NOR— набора, и прохождение нормального мейоза и рекомбинации двумя наборами NOR+.
По данным мультилокусного фингерпринта Шток и соавторы [25] определили несколько генотипов среди потомства одной пары. Однако, доминантные мультилокусные маркеры не всегда четко интерпретируемы, и ткаим образом не позволяют пролить света на основной механизм. В настоящей работе мы провели анализ групп потомков по 15 кодоминирующим локусам микростеллитов, чтобы установить характерные для геномов модели передачи и сегрегации. Наши результаты ясно подтверждают чисто клональную материнскую передачу одного набора хромосом (NOR— ) и показывают независимую сегрегацию и рекомбинацию двух других наборов (NOR+) у самцов и самок. Эти перетасовки генетического материала должны давать возможность для эффективного очищение двух наборов хромосом NOR+, как при нормальном половом размножении. Это первый пример параллельной клональной и мейотической передачи хромосомных наборов в пределах одной линии позвоночных.
2. Материалы и методы
Животные, использованные в контролируемых экспериментальных скрещиваниях, были отловлены в трех населенных пунктах на севере Пакистана (электронный дополнительный материал, таблицы S1) в течение трех периодов полевых работ (июнь-июль 1996, 1997 и 2000). Мы провели пять экспериментов с разведением триплоидных пуштунских жаб. Кроме того, мы скрестили одну самку пуштунской жабы как с диплоидным самцом Bufo variabilis из Сирии (2n = 22, с двумя NOR+ наборами), так и с тетраплоидным самцом Bufo oblongus из Ирана (4n = 44,срдержащий два NOR+ и два NOR— набора; [28]). Двадцать из 100 потомков были выращены в резервуарах до личинки длиной 2-3 см (Gosner-этапы от 30 до 38, [29]). Всего у 85 головастиков от семи скрещиваний были отобраны пробы для генетического анализа. Головастики были либо кариотипированы, либо их плоидность определяли с помощью проточной цитометрии; ДНК выделяли, как описано у Штока и соавторов [30].
Мы протестировали серии микросателлитных маркеров из генетической библиотеки повторяющихся элементов пуштунских жаб, некоторые из которых ранее использовались для других видов (электронные дополнительные материалы, таблицы S2). Аллели были амплифицированы, помечены GeneMapper v. 3.7 (Applied Bio- systems), и названы в зависимости от их длины в парах оснований, как описано [30]. Аллели от NOR + и NOR— наборов, а также нулевые аллели (0) были определены по характеру наследования (см. § 3). Анализ связи проводили в GENEPOP (https://genepop.curtin.edu.au/, [31,32]) с параметрами по умолчанию, и потенциальные группы связей были проверены при визуальном осмотре. Учитывая обозримый размер набора данных, генотипы потомства были визуально осмотрены на случаи рекомбинации. Количество рекомбинаций было нормированным по отношению к числу информативных событий в паре, и отклонения от случайной сегрегации были протестированы на значимость (с помощью X-теста).
3. Результаты
(а) Характер наследования у пуштунской жабы
В общей сложности 15 пар праймеров микроссателлитов амплифицировано в одной или нескольких семьях.
Пять из них (D103, D105, D5, C224 и C203, электронные дополнительные материалы, набор данных S1) отображается в трех аллелях на особь, которые предполагают амплификацию продуктов и с NOR— , и с двух NOR+ наборов. NOR— аллели было легко определить по постоянной гомоморфности среди потомков от пары, идентичной материнской копии и отличающейся от отцовской в тех случаях, когда родительские копии отличались (таблица 1 и дополнительные электронные материалы, таблица S3 и набор данных S1). Оба набора NOR+, напротив, отражают наследование от обоих родителей и менделевскую сегрегацию (дополнительные электронные материалы, таблица S3 и набор данных S1). Каждый гетерозиготный родитель передавал две своих аллели с равной вероятностью (биномиальные тесты).10 других маркеров представлено максимум двумя аллелями на особь, с наследованием от обоих родителей и менделевской сегрегацией, в соответствии с ожиданием для мейотических NOR+ наборов (дополнительные электронные материалы, набор данных S1).
Таблица 1. Паттерн наследования NOR— аллелей в пяти локусах (строки) в пяти 3n парах (столбцы). Указано количество потомства с материнским NOR— аллелем/количество информативных событий. 'ni' показывает неинформативность, (—) означает, что анализ не проводился. По всем локусам и парам мы насчитали 139 случаев материнского наследования из 139 информативных событий. Полные данные представлены в электронном дополнительный материал, набор данных S1.

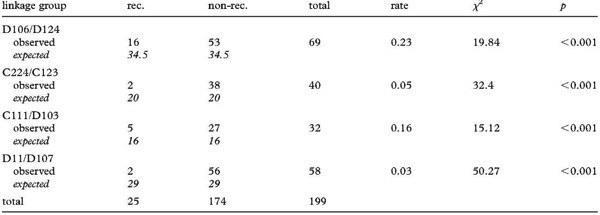
Четыре группы сцепления могут быть определены с участием двух маркеров каждая (таблица 2). Из 199 информативных событий мы обнаружили в общей сложности 25 случаев рекомбинации (таблица 2), происходящих у обоих полов (электронные дополнительные материалы, набор данных S1 и таблица S3). Все остальные пары маркеров передавались независимо друг от друга, порождая большое разнообразие полилокусных генотипов на семью. Интересно, что пять маркеров амплифицирующих NOR— продуктоы относились к различным группам сцепления в NOR+ геноме (табл. 2 и электронные дополнительные материалы, набор данных S1), поддерживая геномное распространение NOR— маркеров.
(b) Межплоидные скрещивания
Локус D105 также может быть амплифицирован у потомства самки B. baturae и (i ) диплоидного самца B. variabilis (2n = 22, имеющего два NOR+ набора) и (ii) тетраплоидного самца B. oblongus (4n = 44 в том числе два NOR+ и два NOR— набора). Все потомство от осеменения самцом B. variabilis, было триплоидным и унаследовало материнскую NOR— аллель в локусе D105, а два NOR+ набора показали наследование от двоих родителей с менделевской сегрегацией у обоих. Потомство от оплодотворения B. oblongus, было тетраплоидным и представляло четыре аллельные копии в локусе D105, соответствующие двум NOR— и двум NOR+ наборам. Одна NOR— аллель была идентична материнской копии, а другая была случайно унаследованной от двух отцовских NOR— копий. Два NOR+ набора также показали наследование от двоих родителей, с менделевской сегрегации у обоих . Следовательно, в обоих скрещиваниях, пуштунская жаба-мать производила 2n ооциты с клонально передающимся NOR— и рекомбинантным NOR +. Самец B. variabilis производил сперму с гаплоидным рекомбинированным NOR+, в то время как самец B. oblongus производил диплоидные сперматозоиды с рекомбинантными NOR+ и NOR— наборами (см. также [25,33]).
Таблица 2. Модель рекомбинации в четырех группах сцепления. Rec., рекомбинация наблюдалась; non-rec., рекомбинация не наблюдалась. Значения, ожидаемые при условии независимости наследования, набраны курсивом. Total указывает общее число информативных событий по парам и полам.
4. Обсуждение
Наши результаты показывают чисто материнскую и клональную передачу всех NOR— маркеров. Потомство наследует только материнские копии пяти маркеров (D5, D103, D105, C224 и C203), которые амплифицируются в NOR— аллели. Как будет показано, эти пять маркеров локализованы в различных группах сцепления на NOR+ геномах (электронный дополнительный материал, набор данных S1), что подкрепляет предположение о том, что весь NOR— набор хромосом подвергается клональной материнской передаче.
Кроме того, наши результаты свидетельствуют о NOR+ рекомбинации у обоих полов.15 маркеров, которые амплифицировали NOR+ аллели, были распределены по 11 различным группам сцепления (соответствующим гаплоидному числу хромосом у пуштунской жабы), которые отражают случайную и независимую сегрегацию у обоих полов (электронный дополнительный материал, набор данных S1). Гетерозиготные взрослые всегда передают две свои аллели с равной вероятностью, что указывает на случайную сегрегацию отцовского и материнского NOR+ хромосомных наборов у обоих полов (рис. 2: пути (б), (г)). Кроме того, рекомбинация также происходила у обоих полов между локусами из одной и той же группы сцепления (таблица 2).
В общей сложности наши результаты исключают гипотезу (а) для оогенеза (предполагающую клональное производство NOR+/NOR— ооцитов) и (с) для сперматогенеза (предполагающую клональное производства NOR спермы +). Эти результаты ставят важные вопросы, касающиеся подобных механизмов и эволюционных последствий, связанных с этим необычным способом размножения.
(a) Сходные механизмы
NOR— геном пуштунских жаб элиминируется у самцов, но дуплицируется у самок до мейоза. Премейотическая элиминация и/или дупликация геномов уже были описаны у гибридогенетических позвоночных, таких, как зеленые лягушки Rana (Pelophylax) esculenta, гибрид между Rana ridibunda (RR) и Rana lessonae (LL) [33,34]. Когда живущие с Р. ridibunda, R. esculenta самки (RL) теряют родительский геном (R) из зародышевой линии, и в то же время удваивают свои L геномы путем премейотического эндомитоза. Следующий за этим мейоз таким образом включает в себя полностью гомозиготныхе псевдобиваленты (LL) и производит нерекомбинтные гаплоидные (L) ооциты [35]. Спаривание с самцом R. ridibunda в последствие восстанавливает геном RL. Таким образом, один набор хромосом (R) рекомбинирует в родительских видах, в то время как другой набор (L), передается клонально у гибридов.
Оба набора хромосом рекомбинируют при мейотическом гибридогенезе [15,36], который включает в себя репродуктивные сообщества гибридов различной плоидности и геномного состава (RRL, LLR и RL). Триплоиды RRL удаляют L геном из зародышевой линии, и производят рекомбинантные гаплоидные R гаметы в ходе нормального мейоза. Триплоиды LLR аналогичным образом удаляют R геном до мейоза, производя рекомбинантные гаплоидные гаметы L. Наконец, RL диплоиды формируют клональные диплоидные гаметы RL после эндомитоза [11]. Сочетание этих гамет восстанавливает исходные диплоидные и триплоидные геномы [36-38]. Подобные механизмы были зарегистрированы у нескольких гибридогенетических костистых рыб [39-44].
Таким образом, премейотическое устранение NOR— у самцов пуштунских жаб, с последующим нормальным диплоидным мейоз двух NOR+ наборов имеет сходство с некоторыми процессами, происходящими во время мейотического гибридогенеза и других форм гибридогенетического или клептогенетического способа воспроизводства, известного у триплоидных позвоночных (рис. 1). Кроме того, дупликация NOR— у самок пуштунской жабы происходит через гаметогенетический механизм (премейотический эндомитоз), который хорошо известен у патреногенетических и гибридогенетических позвоночных [23,45,46]. Тем не менее, система пуштунской жабы кажется уникальной среди позвоночных в том, что (i) процесс мейоза различается у разных полов, и (ii) самки одновременно передают один геном, который дублируется клонально, и другой, который проходит нормальный мейоз. Ближайшая система, похоже, была найдена у растений, таких как вереск и шиповник, у которых пыльца передает только геном воспроизведенный половым путём, в то время как яйцеклетки дополнительно передают клонально воспроизведенный геном [47-49]. Однако в этих случаях не происходит премейотическая дупликация клональных геномов. По нашим сведениям, автодупликация одного полного набора хромосом (NOR— ) в присутствии иных диплоидных геномов (NOR+/NOR+', которые остаются прейотически неизменными и позже передаются менделевским образом) до сих пор не показана (рис. 1).
(b) Эволюционные аспекты
Пуштунские жабы демонстрируют удивительную однородность (в пределах вида) митохондриальных последовательностей [50], что позволяет предположить уникальное и недавнее происхождение (хотя ни один из его потенциальных родительских видов не встречается в пределах ареала вида, который включает в себя водосборные бассейны трех рек северного Пакистана). Хотя триплоиды могут возникать непосредственно при скрещивании диплоидных и тетраплоидных родительских видов, комплекс мейотических процессов описанных здесь (включая дупликацию целого генома у самок и его элиминацию у самцов), не мог возникнуть сразу при исходном событии гибридизации. Промежуточные этапы могли включать периодические гибридные взаимодействия между линиями различной плоидности и геномного состава, подобные ситуации происходят сейчас в северной Киргизии, где некоторые триплоидные самцы, возникающие в результате естественных скрещиваний 2n Bufo turanensis самок с 4n Bufo pewzowi самцами, осуществляют обратные скрещивания с самками любого из родительских видов [30]. Однако, такие механизмы должны быть редкими, из-за низкой вероятности встречи комплекса генетических условий, необходимых для достижения стабильных гибридных комбинаций клональных и менделевских геномов, что в последнее время также предполагаются для старых линий гиногенетических рыб [51].
Этот способ воспроизводства также поднимает вопрос касательно селективных процессов и эволюционной судьбы. Полиплоидные (3n, 4n) линии зеленых жаб, которые развивались независимо друг от друга несколько раз, явно связаны с суровыми средами обитания [50]. Пуштунские жабы, в частности, живут в экстремальных условиях высоты и засушливости [52]. Одно из возможных предположений заключается в том, что клональное воспроизводство NOR— генома позволяет сохранить эпистатические компоненты жизнеспособности, которая может иметь значение при отборе вытекающем из абиотических и предсказуемо суровых природных факторов [53]. На самом деле, бесполые линии часто встречаются в маргинальных местообитаниях с более экстремальными условиями (холодные, сухие, большой высоты и повышенного УФ-излучения), чем их половые родственников [54-57]. Важный вопрос в этом контексте заключается в том, экспресируются ли оба генома, и если это так, является ли экспрессия дифференциальной (тканеспецифичной), как это наблюдается у аллополиплоидных рыб [58] и растений [59].
Этот исключительный режим NOR— наследования должен также иметь неблагоприятные эволюционные последствия. Во-первых, чисто материнская передача открывает возможности для геномных конфликтов. Мы ожидаем, в частности, что факторы феминизации развиваются на материнский NOR— , чтобы потом уравновешиваться факторами маскулинизации, эволюционирующими в NOR+, которые передаются от обоих родителей. Это может привести к полоспецифичному смещению, как это наблюдается у гибридогенетических R. esculenta, где матерински передающийся клональный геном R несет только факторы феминизации [60]. Подобным образом, мутации, которые являются вредными только для самцов, не будут удаляться отбором и могут накапливаться, например, как это встречается и в других передающихся по материнской линии митохондриальных [61] или ядерных [62] геномах.
Во-вторых, нерекомбинирующий NOR— набор должен постепенно накапливать вредные мутации вследствие сочетания сил повышенного дрейфа, селективного преимущества, фонового отбора и храповика Мёллера [63-65], как это происходит с половыми хромосомами (Y или W), а также нерекомбинирующими геномами гемиклональных позвоночных [66]. Пуштунская жаба, однако, могла возникнуть слишком недавно, для того чтобы такие мутационные кризисы или геномные конфликты из-за определения пола могли быть обнаружены [25,50].
Наоборот, менделевская сегрегация и рекомбинация, найденная в NOR+ геноме, должны препятствовать его эволюционному вырождению, обеспечивая долгосрочный эволюционный потенциал пуштунских жаб, характерный для размножающихся половым путем позвоночных с нормальным мейозом.
Сравнение последовательностей генов из NOR— генома B. baturae с таковыми его родительских видов, а также тетраплоидных линий зеленых жаб, как B. oblongus и B. pewzowi, где NOR— геномы рекомбинируют в соответствии с цитологическими [28] и микросателлитными (данное исследование) доказательствами, может помочь получить информацию не только о филогенетической истории NOR— наборов, но и о характере отбора, действующего на этот нерекомбинирующий геном. Это может также позволить исследование потенциальных конфликтов в путях определения пола, а также возможных интергеномных рекомбинаций, в частности, наблюдаемых у клептогенетически воспроизводящихся амбистом [67].
5. Заключение
Способ воспроизводства пуштунской жабы отличается от известных до сих пор у других позвоночных (рис. 1) не только потому, что мейотические процессы различаются у разных полов, но и потому, что самки демонстрируют клональное и половое размножение одновременно (явление премейотической автодупликации затрагивает один хромосомный набор, в то время как другой проходит нормальный мейоз). Здесь мы назвали этот процесс "предварительно выравненным гибридным мейозом». Выяснение механизмов, лежащих за этими особенностями, могло бы пролить свет на общие процессы регуляции мейоза у позвоночных. Пуштунские жабы также представляют интригующую возможность сравнить эволюционные силы в рекомбинирующих и нерекомбинирующих геномах в пределах одного организма.
Литература
1 Mendel, G. 1866 Versuche uber Pflanzenhybriden [Experiments on plant hybridization]. Verh. Naturforsch. Ver. Briinn 4, 3-47. [In German.]
2 Keller, L. 2010 Genetics: biased transmission of genomes according to parents of origin. Curr. Biol. 20, R601- R602. (doi:10.1016/j.cub.2010.05.048)
3 Helms Cahan, S. & Keller, L. 2003 Complex hybrid origin of genetic caste determination in harvester ants. Nature 424, 306-309. (doi:10.1038/nature01744)
4 Fournier, D., Estoup, A., Orivel, J., Foucaud, J., Jourdan, H., Le Breton, J. & Keller, L. 2005 Clonal reproduction by males and females in the little fire ant. Nature 435, 1230-1234. (doi:10.1038/nature03705)
5 Kulmuni, J., Seifert, B. & Pamilo, P. 2010 Segregation distortion causes large-scale differences between male and female genomes in hybrid ants. Proc. Natl Acad. Sci. USA 107, 7371-7376. (doi:10.1073/pnas. 0912409107)
6 Schultz, R. J. 1969 Hybridization, unisexuality and poly- ploidy in the teleost Poeciliopsis (Poeciliidae) and other vertebrates. Am. Nat. 103, 605-619. (doi:10.1086/ 282629)
7 Darevsky, I. S. 1958 Natural parthenogenesis in certain subspecies of rock lizards, Lacerta saxicola Eversmann. Dokl. Akad. Nauk SSSR, Biol. Sci. 122, 730. [In Russian.]
8 Kearney, M., Fujita, M. K. & Ridenour, J. 2009 Lost sex in the reptiles: constraints and correlations. In Lost sex: the evolutionary biology of parthenogenesis (eds I. Schoen, K. Martens & P. van Dijk), pp. 447-474. Heidelberg, Germany: Springer.
9 Beukeboom, L. W. & Vrijenhoek, R. C. 1998 Evolutionary genetics and ecology of sperm-dependent parthenogenesis. J. Evol. Biol. 11, 755-782. (doi:10. 1007/s000360050117)
10 Bogart, J. P. & Klemens, M. W. 1997 Hybrids and genetic interactions of mole salamanders (Ambystoma jeffersonianum and A. laterale) (Amphibia: Caudata) in New York and New England. Am. Mus. Novit. 3, 1-78.
11 Polls-Pelaz, M. 1994 Modes of gametogenesis among kleptons of the hybridogenetic water frog complex: an evolutionary synthesis. Zool. Polon. 39, 123-138.
12 Morishima, K., Horie, S. Y. E. & Arai, K. 2002 A cryptic clonal line of the loach Misgurnus anguillicaudatus (Tele- ostei: Cobitidae) evidenced by induced gynogenesis, interspecific hybridization, microsatellite genotyping and multilocus DNA fingerprinting. Zool. Sci. 19, 565-575. (doi:10.2108/zsj.19.565)
13 Oshima, K., Morishima, K., Yamaha, E. & Arai, K. 2005 Reproductive capacity of triploid loaches obtained from Hokkaido Island, Japan. Ichthyol. Res. 52, 1-8. (doi:10.1007/s10228-004-0245-3)
14 Alves, M. J., Coelho, M. M. & Collares-Pereira, M. J. 1998 Diversity in the reproductive modes of females of the Rutilus alburnoides complex (Teleostei, Cyprinidae): a way to avoid the genetic constraints of uniparentalism. Mol. Biol. Evol. 15, 1233-1242.
15 Gunther, R., Uzzell, T. & Berger, L. 1979 Inheritance patterns in triploid Rana 'esculenta' (Amphibia, Salientia). Mitt. Zool. Mus. Berlin 55, 35-37.
16 Vinogradov, A. E., Borkin, L. J., Gunther, R. & Rosanov, J. M. 1990 Genome elimination in diploid and triploid Rana esculenta males: cytological evidence from DNA flow cytometry. Genome 33, 619-627. (doi:10.1139/g90-092)
17 Charles, J. S., Hamilton, M. L. & Petes, T. D. 2010 Meiotic chromosome segregation in triploid strains of Saccharomyces cerevisiae. Genetics 18, 537-550. (doi:10. 1534/genetics.110.121533)
18 Comai, L. 2005 The advantages and disadvantages of being polyploid. Nat. Rev. Gen. 6, 836-846. (doi:10. 1038/nrg1711)
19 Schultz, R. J. 1967 Gynogenesis and triploidy in the viviparous fish Poeciliopsis. Science 157, 1564-1567. (doi:10. 1126/science.157.3796.1564)
20 Mateos, M. & Vrijenhoek, R. C. 2005 Independent origins of allotriploidy in the fish genus Poeciliopsis. J. Hered. 96, 32-39. (doi:10.1093/jhered/esi010)
21 Monaco, P., Rasch, E. & Balsano, J. 1984 Apomictic reproduction in the Amazon molly, Poecilia formosa, and its triploid hybrids. In Evolutionary genetics of fishes (ed. B. Turner), pp. 311-318. New York, NY: Plenum Press.
22 Bogart, J., Bi, K., Fu, J., Noble, D. & Niedzwiecki, J. 2007 Unisexual salamanders (genus Ambystoma) present a new reproductive mode for eukaryotes. Genome 50, 119-136. (doi:10.1139/G06-152)
23 Avise, J. 2008 Clonality. Oxford, UK: Oxford University Press.
24 Lamatsch, D. & Stock, M. 2009 Sperm-dependent parthenogenesis and hybridogenesis in teleost fishes. In Lost sex: the evolutionary biology of parthenogenesis (eds I. Schoen, K. Martens & P. van Dijk), pp. 399-432. Heidelberg, Germany: Springer.
25 Stock, M. et al. 2002 A bisexually reproducing all- triploid vertebrate. Nat. Genet. 30, 325-328. (doi:10. 1038/ng839)
26 Stock, M., Schmid, M., Steinlein, C. & Grosse, R. 1999 Mosaicism in somatic triploid specimens of the Bufo viridis complex in the Karakoram with examination of calls, morphology and taxonomic conclusions. Ital. J. Zool. 66, 215-232. (doi:10.1080/11250009909 356259)
27 Uzzell, T. 1970 Meiotic mechanisms of naturally occurring unisexual vertebrates. Am. Nat. 104, 433-445. (doi:10.1086/282678)
28 Stock, M., Steinlein, C., Lamatsch, D. K., Schartl, M. & Schmid, M. 2005 Multiple origins of tetraploid taxa in the Eurasian Bufo viridis subgroup. Genetica 124, 255-272.
29 Gosner, L. K. 1960 A simplified table for staging anuran embryos and larvae with notes on identification. Herpetologica 16, 513-543.
30 Stock, M., Ustinova, J., Lamatsch, D. K., Schartl, M., Perrin, N. & Moritz, C. 2010 A vertebrate reproductive system involving three ploidy levels: hybrid origin of triploids in a contact zone of diploid and tetraploid Palearctic green toads (Bufo viridis subgroup). Evolution 64, 944-959. (doi:10.1111/j.1558-5646.2009.00876.x)
31 Raymond, M. & Rousset, F. 1995 GENEPOP (version 1.2): population genetics software for exact tests and ecumenicism. J. Hered. 86, 248 -249.
32 Rousset, F. 2008 GENEPOP'007: a complete reimplemen- tation of the GENEPOP software for Windows and Linux. Mol. Ecol. Res. 8, 103-106. (doi:10.1111/j.1471-8286. 2007.01931.x)
33 Kauri, H. 1954 Uber die systematische Stellung der Europaischen Griinen Frosche Rana esculenta L. und Rana ridibunda Pall. [On the systematic position of the European green frogs Rana esculenta L. and Rana ridi- bunda Pall]. Acta Univ. Lund. N.F. 5, 1 -30. [In German.]
34 Berger, L. 1968 Morphology of the F1 generation of various crosses within Rana esculenta complex. Acta Zool. Cracow 13, 301-324.
35 Graf, J.-D. & Muller, W. P. 1979 Experimental gynogen- esis provides evidence of hybridogenetic reproduction in the Rana esculenta complex. Experientia 35, 1574-1576. (doi:10.1007/BF01953200)
36 Christiansen, D. G. & Reyer, H. U. 2009 From clonal to sexual hybrids: genetic recombination via triploids in all-hybrid populations of water frogs. Evolution 63, 1754-1768. (doi:10.1111/j.1558-5646.2009.00673.x)
37 Gunther, R. 1990 Die Wasserfrosche Europas [The water frogs of Europe]. Die Neue Brehm-Bucherei, vol. 600. [In German.] Wittenberg, Germany: Ziemsen
38 Christiansen, D. G. 2009 Gamete types, sex determination and stable equilibria of all-hybrid populations of diploid and triploid edible frogs (Pelophylax esculentus). BMC Evol. Biol. 9, 135. (doi:10.1186/1471-2148-9-135)
39 Goddard, K. A. & Schultz, R. J. 1993 Aclonal reproduction by polyploid members of the clonal hybrid species Phoxinus eos-neogaeus (Cyprinidae). Copeia 3, 650-660. (doi:10.2307/1447226)
40 Goddard, K. A., Megwinoff, O., Wessner, L. L. & Giaimo, F. 1998 Confirmation of gynogenesis in Phoxinus eos-neogaeus (Pisces: Cyprinidae). J. Hered. 89, 151-157. (doi:10.1093/jhered/89.2.151)
41 Kim, I. S. & Lee, E. H. 2000 Hybridization experiment of diploid-triploid cobitid fishes, Cobitis sinensis-longicor- pus complex (Pisces: Cobitidae). Folia Zool. 49, 17-22.
42 Alves, M. J., Coelho, M. M. & Collares-Pereira, M. J. 2001 Evolution in action through hybridisation and polyploidy in an Iberian freshwater fish: a genetic review. Genetica 111, 375-385. (doi:10.1023/A:1013 783029921)
43 Itono, M., Morishima, K., Fujimoto, T., Bando, E., Yamaha, E. & Arai, K. 2006 Premeiotic endomitosis produces diploid eggs in the natural clone loach, Misgurnus anguillicaudatus (Teleostei: Cobitidae). J. Exp. Zool. 305A, 513-523. (doi:10.1002/jez.a.283)
44 Morishima, K., Yoshikawa, H. & Arai, K. 2008 Meiotic hybridogenesis in triploid Misgurnus loach derived from a clonal lineage. Heredity 100, 581-586. (doi:10.1038/ hdy.2008.17)
45 Butlin, R., Schon, I. & Griffiths, H. I. 1998 Introduction to reproductive modes. In Sex and parthenogenesis: evolutionary ecology of reproductive modes in non-marine ostracodes (ed. K. Martens), pp. 1-24. Leiden, The Netherlands: Backhuys Publ.
46 Lutes, A. A., Neaves, W. B., Baumann, D. P., Wiegraebe, W. & Baumann, P. 2010 Sister chromosome pairing maintains heterozygosity in parthenogenetic lizards. Nature 464, 283-287. (doi:10.1038/nature08818)
47 Smith-White, S. 1948 Polarised segregation in the pollen mother cells of a stable triploid. Heredity 2, 119-129. (doi:10.1038/hdy.1948.7)
48 Werlemark, G., Uggla, M. & Nybom, H. 1999 Morphological and RAPD markers show a highly skewed distribution in a pair of reciprocal crosses between hemi- sexual dogrose species, Rosa sect. Caninae. Theor. Appl. Gen. 98, 557-563. (doi:10.1007/s001220051104)
49 Nybom, H. 2007 Unique reproduction in dogroses (Rosa sect. Caninae) maintains successful and highly heterozygous genotypes. In Apomixis (eds E. Horandl, U. Grossniklaus, P. J. van Dijk & T. F. Sharbel), pp. 281-298. Koenigstein, Germany: Koeltz Scientific Books.
50 Stock, M., Moritz, C., Hickerson, M., Frynta, D., Dujsebayeva, T., Eremchenko, V., Macey, J. R., Papenfuss, T. J. & Wake, D. B. 2006 Evolution of mito- chondrial relationships and biogeography of Palearctic green toads (Bufo viridis subgroup) with insights in their genomic plasticity. Mol. Phylogenet. Evol. 41, 663-689. (doi:10.1016/j.ympev.2006.05.026)
51 Stock, M., Lampert, K. P., Moller, D., Schlupp, I. & Schartl, M. 2010 Monophyletic origin of multiple clonal lineages in an asexual fish (Poecilia formosa). Mol. Ecol. 19, 5204-5215. (doi:10.1111/j.1365-294X.2010. 04869.x)
52 Litvinchuk, S. N. et al. 2011 Influence of environmental conditions on the distribution of Central Asian green toads with three ploidy levels. J. Zool. Syst. Evol. Res. 9, 233-239. (doi:10.1111/j.1439-0469.2010.00612.x)
53 Bell, G. 1982 The Masterpiece of nature: the evolution and genetics of sexuality. London, UK: Croom Helm.
54 Cuellar, O. 1977 Animal parthenogenesis. Science 197, 837-843. (doi:10.1126/science.887925)
55 Lynch, M. 1984 Destabilizing hybridization, general purpose genotypes and geographic parthenogenesis. Quat. Rev. Biol. 59, 257-290. (doi:10.1086/413902)
56 Kearney, M. 2003 Why is sex so unpopular in the Australian desert? Trends Ecol. Evol. 18, 605-607. (doi:10.1016/ j.tree.2003.09.021)
57 Vrijenhoek, R. C. & Davis Parker Jr, D. 2009 Geographical parthenogenesis: general purpose genotypes and frozen niche variation. In Lost sex: the evolutionary biology of parthenogenesis (eds I. Schoen, K. Martens & P. van Dijk), pp. 99-131. Heidelberg, Germany: Springer.
58 Pala, I., Coelho, M. M. & Schartl, M. 2008 Dosage compensation by gene-copy silencing in a triploid hybrid fish. Curr. Biol. 18, 1344-1348. (doi:10.1016/j. cub.2008.07.096)
59 Buggs, R. J. A. et al. 2011 Transcriptomic shock generates evolutionary novelty in a newly formed, natural allopolyploid plant. Curr. Biol. 21, 551-556. (doi:10. 1016/j.cub.2011.02.016)
60 Berger, L., Uzzell, T. & Hotz, H. 1988 Sex determination and sex ratios in western Palearctic water frogs: XX and XY female hybrids in the Pannonian Basin? Proc. Natl Acad. Sci. USA 140, 220-239.
61 Frank, S. A. & Hurst, L. D. 1996 Mitochondria and male disease. Nature 383, 224. (doi:10.1038/383224a0)
62 Archetti, M. 2005 Accumulation of deleterious mutations in the genome of hybridogenetic organisms. J. Theor. Biol. 234, 151-152. (doi:10.1016/j.jtbi.2004. 11.019)
63 Muller, H. 1964 The relation of recombination to mutational advance. Mut. Res. 1, 2-9.
64 Felsenstein, J. 1974 The evolutionary advantage of recombination. Genetics 78, 737-756.
65 Charlesworth, B. & Charlesworth, D. 2000 The degeneration of Y chromosomes. Phil. Trans. R. Soc. Lond. B 355, 1563-1572. (doi:10.1098/rstb.2000.0717)
66 Guex, G. D., Hotz, H. & Semlitsch, R. D. 2002 Deleterious alleles and differential viability in progeny of natural hemiclonal frogs. Evolution 56, 1036-1044.
67 Bi, K. & Bogart, J. P. 2006 Identification of intergenomic recombinations in unisexual salamanders of the genus Ambystoma by genomic in situ hybridization. Cytogenet. Genome Res. 112, 307-312.